U. S. Pharm. 2008; 33(4) (Oncology suppl):20-30. resumo: aproximadamente 75% das mulheres pós-menopáusicas com cancro da mama têm doença hormonal positiva (HR+).O tamoxifeno foi o padrão da terapêutica para o cancro da mama em mulheres pós-menopáusicas até ao advento dos inibidores selectivos da aromatase de terceira geração, que são o anastrozol, o letrozol e o exemestano.Estes fármacos demonstraram uma sobrevivência livre de doença superior em ensaios clínicos comparativamente com tamoxifeno, mas o seu benefício quando utilizados durante mais de cinco anos em mulheres pós-menopáusicas com cancro da mama+ HR não foi estabelecido.3,4
it has been estimated that three – fourths of postmenopausal women with breast cancer have hormone receptor-positive (HR+) disease.1 tamoxifeno-um modulador selectivo do receptor do estrogénio com efeitos estrogénicos nos ossos, tecidos endometriais, lípidos e anti!= efeitos estrogênicos no tecido mamário-foi a terapia padrão para o câncer de HR+ em mulheres pós-menopáusicas até a introdução dos inibidores seletivos da aromatase de terceira geração (AIs).2-4 estes agentes–anastrozol, Letrozol e exemestano–demonstraram uma sobrevivência livre de doença (DFS) superior à do tamoxifeno em ensaios clínicos.3,4 efeitos adversos associados ao uso de tamoxifeno–cancro do endométrio, complicações tromboembólicas e resistência ao tamoxifeno–encorajaram o desenvolvimento de terapias com um mecanismo de acção diferente, como o AIs.2
See TABLE 1 for a summary of important information about the third-generation AIs.
Fundo
O cirurgião Escocês George Beatson descrito hormonal contribuição de estrógenos para a carcinogênese em relação ao câncer de mama em 1896.5 Beatson reconhecido que a remoção dos ovários (ooforectomia) foi benéfico em mulheres com inoperante câncer de mama.Este estado cirurgicamente induzido de privação de estrogénio contribuiu para a inibição do crescimento do tumor nas células do cancro da mama em mulheres com doença HR+.5
aminoglutetimida, originalmente formulada como um agente anticonvulsivante, foi a primeira IA não específica inicialmente promovida no final dos anos 1970 como um agente de segunda linha após o tamoxifeno para mulheres pós-menopáusicas com câncer de mama HR+ avançado.Os efeitos secundários tóxicos, tais como a supressão supra-renal e a necessidade de terapêutica com esteróides, levaram à retirada da aminoglutetimida do mercado.Em mulheres pós – menopáusicas com cancro da mama em fase inicial e tardia, a AIs de terceira geração demonstrou um melhor perfil de toxicidade, mais selectividade, maior potência e melhor eficácia clínica em comparação com os agentes mais velhos. 6
Classificação4,7
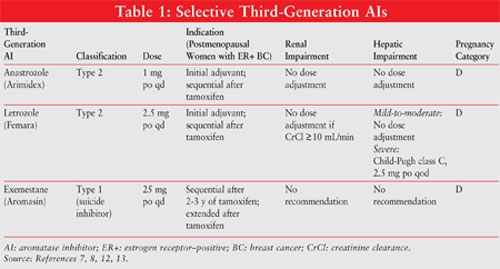
AIs são classificados como do tipo 1 esteróides (não-competitivo, irreversível) ou tipo 2 não esteróides (competitivo, reversível) inibidores. O exemestano, um inibidor do tipo 1, liga-se irreversivelmente ao local da molécula de aromatase e é conhecido como um inibidor de suicídio. Os inibidores do tipo 2 anastrozol e Letrozol ligam-se reversivelmente à aromatase. Ver Figura 1 para as estruturas químicas dos diferentes AIs.
Mecanismo de Ação
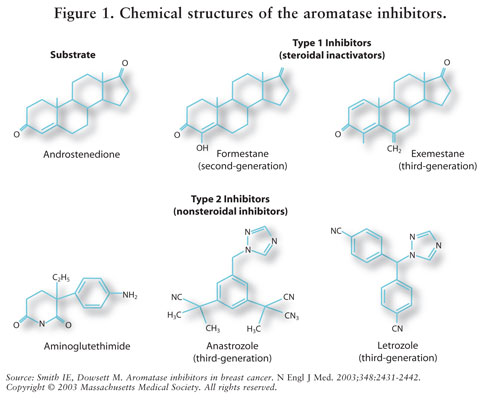
Síntese de estrogênio é mediada pela enzima aromatase.7 a Aromatase converte androstenediona e testosterona em estrona e estradiol.5, 7 AIs reduzem o estrogénio em mulheres pós-menopáusicas, inibindo assim o seu efeito carcinogénico no tecido mamário.Uma vez que os ovários de mulheres pré-menopáusicas ainda estão a funcionar, AIs não está indicada para esta população fora dos ensaios clínicos; nestas mulheres, AIS estimularia o hipotálamo e a pituitária a aumentar a produção de gonadotropinas.4 ver Figura 2.
Toxicities6,8
os efeitos Adversos de AIs incluem disfunção cardiovascular, tais como hipertensão, vasodilatação, edema e dor no peito. É necessário um estudo adicional para avaliar o efeito total dos AIs na função cardíaca. Os doentes podem apresentar diminuição da densidade mineral óssea (DMO), aumento do risco de fractura, sintomas vasomotores, secura vaginal, dor musculoesquelética, cefaleias, insónia, depressão, aumento da tosse, dispneia, desconforto gastrointestinal, aumento de peso e possivelmente níveis lipídicos elevados. A perda óssea é um efeito secundário predominante; bifosfonatos como o ácido zoledrónico têm sido usados para o neutralizar. Os doentes em tratamento com AIs devem receber suplementos de vitamina D e cálcio. Não foram ainda determinados efeitos adversos e efeitos prolongados da terapêutica com IA sobre a função cognitiva.Os AIs estão contra-indicados em mulheres grávidas. Interacções medicamentosas o anastrozol inibe o CYP1A2, CYP2C9 e CYP3A4.10.11 o letrozol é metabolizado pelos CYP2A6 e CYP2C19, e o exemestano metaboliza o CYP3A4.8. 10-13 indutores do CYP3A4 tais como a rifampina, fenitoína, carbamazepina e hipericão podem causar uma diminuição nos níveis de exemestano quando administrados concomitantemente. O 8, 12, 13 Tamoxifeno provoca uma diminuição de 38% no Letrozol e uma diminuição de 27% no anastrozol quando co-administrado.2,7,8,14
Indicações e Dosagem
Anastrozol 10,11: Anastrozol 1 mg uma vez ao dia, é indicado para início de câncer de mama inicial como terapia adjuvante em mulheres pós-menopáusicas com hormônios sensíveis a doença e como primeira linha para RH+ ou RH-desconhecido metastático ou localmente avançado da doença. Também está aprovado para utilização após a terapêutica com Tamoxifeno em mulheres com doença progressiva. Não é necessário um ajuste da Dose em caso de compromisso renal ou compromisso hepático ligeiro a moderado.
Letrozole11,12: Letrozole 2.5 mg uma vez por dia está indicado em mulheres pós-menopáusicas com cancro da mama em Estadio precoce como terapêutica inicial ou como terapêutica adjuvante prolongada após tamoxifeno. Também está indicado para a doença metastática HR+ ou HR-desconhecida. São recomendados ajustes de Dose para compromisso hepático grave.
Exemestane11,14: Exemestane 25 mg po uma vez ao dia, é indicado como terapia adjuvante de dois a três anos seguintes tamoxifeno para mulheres pós-menopausa com RH+ precoce do cancro da mama, para um total de cinco anos consecutivos de terapia hormonal. Também pode ser utilizado para doenças que progrediram após a terapêutica com tamoxifeno. Deve ser tomado após uma refeição. O ajuste da Dose é desnecessário para a disfunção hepática ou renal
ensaios clínicos
toxicidades relacionadas com tamoxifeno, tais como o cancro do endométrio, levaram ao início de ensaios clínicos em larga escala que investigaram a utilização de AIs de terceira geração em mulheres pós-menopáusicas com cancro da mama+ HR. Foram utilizados vários modelos de ensaio para avaliar o desempenho destes agentes em comparação com o tamoxifeno.Resultados superiores em termos de eficácia clínica e perfis de toxicidade estabeleceram AIs como um novo padrão de terapêutica adjuvante em mulheres pós-menopáusicas com cancro da mama+ HR.6
ATAC15: ATAC (Arimidex, Tamoxifeno Sozinho ou em Combinação), um ensaio multicêntrico, randomizado, duplo-cego, estudo, em comparação com tratamento de três braços: o tamoxifeno 20 mg + anastrozol placebo, anastrozol 1 mg + tamoxifeno placebo, e uma combinação de tamoxifen 20 mg + anastrozol 1 mg. O objectivo primário foi avaliar a segurança e eficácia do tamoxifeno versus anastrozol e a combinação de anastrozol e tamoxifeno durante cinco anos. Um total de 9 366 doentes–3125 no braço de anastrozol, 3116 no braço de tamoxifeno, e 3125 no braço de associação–foram tratados por um período médio de 33 meses.
Depois de três anos, anastrozole demonstrado DFS de 89.4% versus 87.4% para tamoxifen (hazard ratio de 0,83, IC 95%, P =.013). O anastrozol diminuiu a taxa de cancro da mama contralateral (CLBC) em comparação com o tamoxifeno (razão de probabilidades 0, 42 , IC 95%, P =.007). O braço da Associação foi fechado porque não foi encontrado qualquer benefício clínico para além do tamoxifeno. O anastrozol foi associado a efeitos adversos tais como cancro do endométrio (P =.02), hemorragia vaginal, corrimento (p <.0001), acontecimentos cerebrovasculares (P =.Acontecimentos tromboembólicos venosos (p=.0006), e afrontamentos (P <.O tamoxifeno foi associado a menos fracturas e menos dor articular (P <.0001). Após 68 meses, o anastrozol aumentou a DFS (HR 0, 87; IC 95%, P =.01) e tempo até à recorrência (HR 0, 79 , IC 95%, P =.0005) e metástases distantes diminuídas (HR 0, 86 , IC 95%, P =.4) e CLBC (diminuição de 42%, P =.01).Após um intervalo mediano de seguimento de 100 meses, os doentes com HR+ tratados com anastrozol demonstraram melhorias na DFS (hr 0, 85; P =.003), ocorrência de CLBC (HR 0, 60, P =.004), tempo até recorrência (HR 0, 76, P =.0001), e tempo até a recorrência distante (HR 0.84, P =.022) comparativamente aos doentes tratados com tamoxifeno. A diferença absoluta nas taxas de recorrência melhorou de 2.8% após cinco anos para 4,8% após nove anos. As taxas de fracturas de anastrozol foram mais elevadas durante a terapêutica, mas a diferença diminuiu substancialmente após o período de seguimento de 100 meses. O período de tratamento prolongado teve um risco de fractura de 1, 15 com anastrozol versus 1, 02 com tamoxifeno. O risco de câncer de endométrio foi reduzido e fora de anastrozol terapia comparado com tamoxifeno, com uma taxa anual de 0.043 versus 0,14 e 0.014 versus de 0,12, respectivamente. Não foi identificada uma diferença na sobrevivência global (OS).
MA.1712,17: MA.17 foi um ensaio aleatorizado, controlado por placebo, em dupla ocultação que avaliou a eficácia de cinco anos de terapêutica com Letrozol em mulheres pós-menopáusicas com cancro da mama que já tinham completado cinco anos de terapêutica adjuvante com tamoxifeno. Os doentes receberam 2, 5 mg de letrozol ou placebo por dia durante cinco anos. O objectivo primário foi o DFS; os objectivos secundários foram a qualidade de vida, o perfil de segurança alargado e OS. Dos 5187 doentes, 2. 593 receberam Letrozol e 2.594 receberam placebo; a mediana do seguimento foi de 2, 4 anos.
na análise preliminar houve 207 recorrências locais ou metastáticas de cancro da mama ou neoplasias iniciais de CLBC, 75 no grupo do letrozol e 132 no grupo placebo. A taxa DFS prevista para quatro anos para os dois grupos foi de 93% e 87%, respectivamente (P ?.001 para a avaliação dos DF). No braço de letrozol, a DFS teve um HR de 0, 61 (95% IC, p ?.001). O letrozol demonstrou uma diminuição de 43% na incidência do cancro da mama (HR 0, 57 , IC 95%, P =.00008).4 com excepção dos doentes com nódulos positivos (P =.04), OS não alcançou significância estatística (HR 0, 82, P =.30).4 doentes no braço do letrozol apresentaram sintomas vasomotores de baixo grau, mialgia e artrite. A osteoporose foi mais frequente (embora não significativamente) no grupo tratado com Letrozol versus placebo (5, 8% vs. 4, 5%; P =.7), e as taxas de fracturas foram comparáveis entre os braços. O estudo foi fechado após uma mediana de 2, 4 anos devido a uma diminuição dos acontecimentos do cancro da mama no braço do letrozol. Tratamento adjuvante prolongado com Letrozol após conclusão de cinco anos de tratamento com tamoxifeno melhorou a DFS.
BIG 1-987,9,18: The Breast International Group (BIG) 1-988 study, a double-blind, multicenter, randomized trial, matriculated 8.028 postmenopausal women with HR+ early-stage breast cancer. O estudo composto por quatro tratamentos braços que avaliaram cinco anos de tamoxifen em monoterapia, cinco anos de letrozole monoterapia, tamoxifeno por dois anos, então mude para o letrozole por três anos, ou letrozol por dois anos, em seguida, alternar para tamoxifeno por três anos. O principal objectivo era o DFS; os objetivos secundários foram o tempo para metástases distantes, segurança e OS. A DFS aumentou nos doentes que receberam Letrozol em comparação com os que receberam tamoxifeno (HR 0, 81 , IC 95%, redução relativa 19%, P =.003), com uma diferença absoluta de 1, 5% aos três anos. O tamoxifeno aumentou a ocorrência de acontecimentos tromboembólicos em comparação com o letrozol (ou 0, 38, P<.0001). As fracturas ósseas aumentaram no braço do letrozol (ou 1, 44, P =.006).
IES14,19: O estudo IES (Intergrupo Exemestane) foi um estudo de fase III aleatorizado, em dupla ocultação, multicêntrico, cujo objectivo era determinar se a mudança para exemestano após dois a três anos de tamoxifeno era mais eficaz do que a continuação do tamoxifeno durante cinco anos. O estudo recrutou 4,742 mulheres pós-menopausa randomizados para tratamento dois braços; 2,362 sujeitos foram agendadas para mudar para exemestane 25 mg po qd depois de dois a três anos de tamoxifen 20 mg po qd a completar cinco anos de terapia, e o restante de 2.380 foram agendadas para receber tamoxifen 20 mg po qd por cinco anos. Os DFS foram o objectivo primário; os objectivos secundários foram OS OS, o perfil de toxicidade alargado e a frequência de CLBC.
acontecimentos adversos, que ocorreram ao longo de uma mediana de 30, 6 meses, incluíram frequência de CLBC, recorrência local ou metastática e morte. Houve 449 eventos … 183 no braço de exemestano e 266 no braço de tamoxifeno. O braço de exemestano tinha um HR não ajustado de 0 , 68 (95% IC, P <.001 pelo teste log-rank), que demonstrou uma diminuição de 32% no risco e foi análoga a uma vantagem em DFS de 4.75 (IC 95%) aos três anos. Após três anos, o braço de exemestano teve um DFS de 91, 5% (IC 95%) em comparação com 86, 8% (IC 95%) no braço de tamoxifeno. Não houve diferença significativa no sistema operacional entre os dois grupos, com 93 mortes no braço de exemestano e 106 mortes no braço de tamoxifeno. Houve uma diferença significativa na frequência de CLBC (P =.04) — 20 indivíduos no braço do tamoxifeno e 9 no braço do exemestano. A utilização de exemestano para completar os cinco anos de tratamento após dois a três anos de tamoxifeno melhorou o DFS em comparação com cinco anos de tamoxifeno. prevenindo a perda óssea da AI Therapy20 as mulheres pós-menopáusicas são propensas a desenvolver diminuição da DMO devido à redução dos níveis de estrogénio. A terapêutica com IA na doente com cancro da mama pós-menopáusica agrava esta tendência. Denosumab, um anticorpo de investigação monoclonal totalmente humano, liga-se ao activador do receptor para o ligante kB do factor nuclear (RANKL) e previne a actividade RANKL. O RANKL é vital para a actividade osteoclástica, o que significa a quebra do osso. O Denosumab e o risedronato, um bifosfonato, estão a ser avaliados quanto à sua capacidade para neutralizar a perda óssea associada à terapêutica com IA.
Denosumab Study20: um estudo multicêntrico, aleatorizado, de fase III avaliou a utilização de denosumab 60 mg administrado por via subcutânea uma vez de seis em seis meses em mulheres pós-menopáusicas a tomar AIs para cancro da mama não-metastático. O objectivo foi avaliar a alteração da DMO lombar-coluna desde o início até aos 12 meses. Dos 252 doentes, 127 foram atribuídos ao denosumab e 125 ao placebo. Ambos os braços receberam cálcio e vitamina D. A DMO foi avaliada por absorvometria de raios-x de dupla energia. Após 12 e 24 meses de terapia com denosumab ou placebo, houve uma diferença de 5,5% e 7,6%, respectivamente, na DMO aumento na lombar da coluna região em favor de denosumab (P <.0001 Para ambos os meses). O Denosumab demonstrou um perfil de toxicidade comparável ao do placebo. A terapêutica com Denosumab durante mais de 24 meses ainda não foi avaliada.
IBIS-II Bone Sub-Study21: O estudo internacional de Intervenção no cancro da mama-II (IBIS-II) do osso foi derivado do IBIS-II, que avaliou mulheres pós-menopáusicas com uma maior probabilidade de desenvolver cancro da mama que foram aleatorizadas para anastrozol ou placebo durante cinco anos. O sub-estudo, com um registo actual de 700 doentes, está a avaliar o risedronato versus placebo para a prevenção da perda da DMO em mulheres com pontuações T baixas na linha de base. Um subgrupo de doentes do ensaio IBIS-II foi atribuído a uma de três estratégias de tratamento diferentes no sub-estudo. Após um ano de tratamento, 350 doentes com anastrozol e 350 doentes com placebo do IBIS-II receberam resultados de sub-estudo. O estrato 1 incluía 227 doentes a tomar anastrozol com pontuações t normais (pontuação T ?1), o estrato 2 compreendia 80 doentes com osteopenia (ñ2, 5 ? T-score <1), que foram designados para o risedronato 35 mg uma vez por semana ou o placebo, e estrato 3, composta de 43 pacientes com osteoporose (ñ4 <T-score <2.5), que foram designados para o risedronato 35 mg uma vez por semana.
para doentes com osteopenia ou osteoporose na linha de base, o risedronato pareceu inibir a perda óssea associada ao anastrozol. No estrato II, o risedronato demonstrou efeitos favoráveis na preservação da DMO para a anca total, mas não para a coluna lombar (P =.005 E P =.15, respectivamente, vs. placebo). Não foram associados efeitos adversos graves ou interacções medicamentosas com o risedronato.
ensaio de AIs em mulheres pré-menopáusicas (SOFT)21-26
aproximadamente 33% das mulheres com menos de 50 anos serão diagnosticadas com cancro da mama invasivo. O estudo de supressão da função ovárica (SOFT, IBC 24-02, BIG 2-02) está a investigar o uso de terapêutica com IA em mulheres pré-menopáusicas com cancro da mama+ HR. O ensaio, que tem um registo de 3.000 doentes alvo, envolve mulheres pré-menopáusicas com cancro da mama na HR+ que completaram quimioterapia ou que apenas foram submetidas a cirurgia. A ablação ovárica é estabelecida através da administração de triptorelina (uma hormona libertadora de gonadotrofinas) uma vez por mês durante cinco anos, ooforectomia cirúrgica ou irradiação pélvica. Os doentes serão aleatorizados para um dos três braços, com o primeiro braço a receber tamoxifeno uma vez por dia durante cinco anos, o segundo braço a receber tamoxifeno durante cinco anos em associação com a ablação ovárica e o terceiro braço a receber exemestano durante cinco anos em associação com a ablação ovárica. Os doentes receberão exemestano ou tamoxifeno durante cinco anos.
Chemoprevention Trials23-27
Tamoxifen is indicated for breast cancer chemoprevention.O seu perfil de toxicidade é uma causa de restrição no que respeita ao uso terapêutico.A AIs pode reduzir a incidência de cancro da mama+ HR em doentes de alto risco devido a uma diminuição na incidência de CLBC em comparação com Tamoxifeno em ensaios clínicos como o ATAC.6
AI chemoprevention studies include the International Breast Cancer Study Group (IBC) trial 31-03 (IBC 31-03) and the National Cancer Institute of Canada’s MAP.3 julgamento. O objectivo principal do ensaio IBC 31-03 multicêntrico, internacional, aleatorizado e controlado por placebo é avaliar a utilização de anastrozol na prevenção do cancro da mama em mulheres pós-menopáusicas. O seu principal resultado é a incidência de cancro da mama invasivo e não invasivo; o resultado secundário é a incidência de osteoporose e fracturas.5 o ensaio IBC 31-03 tem um registo de 6.000 alvos. mapa.3 o ensaio avalia o exemestano como um agente quimiopreventivo em mulheres pós-menopáusicas. O objectivo principal do mapa controlado por placebo.O ensaio destina-se a avaliar a eficácia do exemestano na diminuição da incidência de cancro da mama invasivo.
potencial uso futuro: relatos de casos
Letrozol foi usado após falha do clomifeno para induzir a fertilidade em 22 mulheres com síndrome de ovário policístico. O letrozol induziu a ovulação em 75% dos ciclos versus 44, 4% dos ciclos induzidos pelo clomifeno. Quatro gravidezes resultaram das ovulações induzidas pelo Letrozol e não foram associados efeitos adversos significativos ao Letrozol.28,29
a 57-year-old obese woman with endometriosis following hysterectomy and bilateral salpingo-oophorectomy received anastrozole after megestrol therapy. O doente não apresentou lesões no endométrio após nove meses.28,30
Um paciente com McCune-Albright síndrome foi dada anastrozol para puberdade precoce; o paciente estradiol normalizado após 2,5 anos de anastrozol e a idade óssea avançada por seis meses.O aumento do estrogénio pode induzir ginecomastia e hipogonadismo hipogonadotrópico.28. 31 a diminuição do estrogénio com uma IA resultou em gonadotropina e testosterona normais em homens com ginecomastia e hipogonadismo hipogonadotrópico. 28, 31, 32
Letrozol foi estudado em doentes com recidiva do cancro do ovário; os doentes que receberam Letrozol tiveram estabilização da doença.28, 33 Neoadjuvant Letrozol foi administrado a 10 mulheres pós-menopáusicas com cancro do endométrio; o medicamento demonstrou mudanças clínicas construtivas e não teve impacto cirúrgico negativo.28,34
Quando o tratamento com testolactona versus anastrozol foi comparado em homens inférteis, a eficácia dos dois agentes foi semelhante.28. 35 doentes com síndrome de Klinefelter tiveram um tratamento mais eficaz com testolactona do que com anastrozol.28,35
Conclusões
A terceira geração AIs têm mostrado superior DFS em mulheres pós-menopáusicas com RH+ o câncer de mama, mas o benefício clínico de mais de cinco anos de AI para o tratamento destas pacientes não foi estabelecida.4 O Estudo Nacional do projecto nacional cirúrgico adjuvante do peito e intestino (NSABP) B-33 (exemestano) e uma subsequente aleatorização do MA.17 (Letrozol) o ensaio irá examinar a utilização destes AIs versus placebo por mais cinco anos.Os AIs são uma alternativa adequada para mulheres com HR+ pós-menopausa nas quais o tamoxifeno está contra-indicado.4
os efeitos benéficos do AIs da terceira geração incluem um perfil de toxicidade mais tolerável e DFS superior em comparação com o tamoxifeno. O nível de eficácia entre estes agentes e o tamoxifeno é comparável. Mantém-se a incerteza quanto à duração seleccionada da terapêutica, ao perfil de toxicidade a longo prazo e à sequência adequada de administração do AIs.4 são necessários novos estudos para produzir moduladores de aromatase selectivos que produzam menos toxicidade do que o AIs.25,36-37
1. Robertson JFR. Fulvestrant(FaslodexÆ) — how to make a good drug better. Oncologista . 2007;12:774-784.
2. Osborne CK. Terapia medicamentosa: tamoxifeno no tratamento do cancro da mama. N Engl J Med. 1998;339:1609-1618.
3. National Cancer Comprehensive Network. Ncccn clinical practice guidelines in oncology — v. 1.2008. Mama. www.nccn.org/professionals/physician_gls/f_guidelines.asp. Accessed October 11, 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Prevenção de cancros relacionados com as hormonas: cancro da mama. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. Aromatase inhibitors in breast cancer. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Inibidores da Aromatase no tratamento e prevenção do cancro da mama. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Drug Information Handbook. 13th ed. Hudson, OH: Lexi-Comp; 2005: 117,598,871.
9. Ellis MJ, ed. Inibidores da Aromatase para o tratamento do cancro da mama. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005:29-45.
10. Folheto informativo Arimidex (anastrozol). Wilmington, DE: AstraZeneca Pharmaceuticals LP; May 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&mostrar=dept&article_id=9884. Accessed March 17, 2008.
14. O Folheto Informativo de aromatasin (exemestano). New York, New York: Pfizer Inc; February 2007.
15. Baum M, Budzar AU, Cuzick J, et al,para o grupo de Trialistas do ATAC. Anastrozol em monoterapia ou em associação com tamoxifeno versus Tamoxifeno em monoterapia no tratamento adjuvante de mulheres pós-menopáusicas com cancro da mama em fase precoce: primeiros resultados do ensaio aleatorizado do ATAC. Lanceta. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al,para o grupo de Trialistas do ATAC. Resultados do ensaio ATAC (Arimidex, Tamoxifeno, em monoterapia ou em associação) após conclusão do tratamento adjuvante de 5 anos para o cancro da mama. Lanceta. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. Um ensaio aleatorizado de letrozol em mulheres pós-menopáusicas após cinco anos de terapêutica com tamoxifeno para o cancro da mama em fase inicial. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS, et al, for the Breast International Group (BIG) 1-98 Collaborative Group. Uma comparação de letrozol e Tamoxifeno em mulheres pós-menopáusicas com cancro da mama em fase precoce. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall e, Gibson Lj, et al, para o estudo do Intergrupo Exemestane. Um ensaio aleatorizado de exemestano após dois a três anos de terapêutica com Tamoxifeno em mulheres pós-menopáusicas com cancro primário da mama. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Um estudo de Fase 3 do efeito da terapêutica com denosumab na densidade mineral óssea em mulheres a receber inibidores da aromatase para o cancro da mama não metastático. Paper presented at: the 30th Annual San Antonio Breast Cancer Symposium; December 13-16, 2007; San Antonio, TX. Abstract 47.
21. Singh S, Cuzick J, Edwards R, et al. Efeito do anastrozol na densidade mineral óssea após um ano de tratamento: resultados do sub-estudo ósseo do estudo internacional de Intervenção no cancro da mama (IBIS-II). Papel apresentado em: the 30th Annual San Antonio Breast Cancer Symposium; December 13-16, 2007; San Antonio, TX. Abstract 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. terapêutica endócrina adjuvante para mulheres pré-menopáusicas com cancro da mama em fase precoce. J Clin Oncol. 2005;23:1736-1750.
23. Instituto Nacional Do Cancro. Tratamento do cancro da mama (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. Accessed December 26, 2007.
24. Baylor College of Medicine Clinical Trials. Supressão do ensaio de função ovárica (SOFT). www.breastcenter.tmc.edu/clinic/trials/soft.htm. Accessed December 26, 2007.
25. Aebi S, Castiglione-Gertsch M. terapêutica endócrina adjuvante para os doentes muito jovens. Mama. 2003;12:509-515.
26. ClinicalTrials.gov-supressão da função ovárica mais tamoxifeno ou exemestano em comparação com Tamoxifeno em monoterapia no tratamento de mulheres pré-menopáusicas com cancro da mama que respondem às hormonas. www.clinicaltrials.gov/. Accessed December 26, 2007.
27. Cuzick J. Inibidores da Aromatase para a prevenção do cancro da mama. J Clin Oncol. 2005;23:1636-1643.
28. Karaer o, OruÁ S, Koyuncu FM. Inibidores da Aromatase: possíveis aplicações futuras. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Utilização de um inibidor da aromatase para indução da ovulação em doentes com uma resposta inadequada ao citrato de clomifeno. Fertilizante. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Papel da aromatase na doença endometrial. J Bioquímica De Esteróides Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Utilização de inibidores da aromatase na puberdade precoce. Cancro Da Relação Endocr. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Excesso de estrogénio associado a novas mutações de ganho de função que afectam o gene da aromatase. N Engl J Med. 2003;348:1855-1865.
33. Bowman a, Gabra H, Langdon SP, et al. A resposta CA 125 está associada à expressão do receptor de estrogénio num ensaio de fase II do letrozol no cancro do ovário.: identificação de um subgrupo endócrino sensível. Clin Cancer Res. 2002;8:2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Neoadjuvant therapy of endometrial cancer with the aromatase inhibitor Letrozol: endocrinine and clinical effects. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Inibidores da Aromatase para a infertilidade masculina. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatase and its inhibitors: significance for breast cancer therapy. Recent Prog Horm Res. 2002;57:317-338.