Värmekurvor
figur \(\PageIndex{3}\) visar en värmekurva, en plot av temperatur kontra uppvärmningstid, för ett 75 g vattenprov. Provet är initialt is vid 1 atm och -23 kcal C; när värme tillsätts ökar isens temperatur linjärt med tiden. Linjens lutning beror på både isens massa och den specifika värmen (Cs) av is, vilket är antalet joules som krävs för att höja temperaturen på 1 g Is med 1 kcal C. När isens temperatur ökar absorberar vattenmolekylerna i iskristallen mer och mer energi och vibrerar mer kraftfullt. Vid smältpunkten har de tillräckligt med kinetisk energi för att övervinna attraktiva krafter och röra sig i förhållande till varandra. När mer värme tillsätts ökar temperaturen i systemet inte ytterligare utan förblir konstant vid 0 msk tills all is har smält. När all is har omvandlats till flytande vatten börjar vattnets temperatur igen öka. Nu ökar emellertid temperaturen långsammare än tidigare eftersom vattnets specifika värmekapacitet är större än isens. När vattentemperaturen når 100 C C börjar vattnet koka. Även här förblir temperaturen konstant vid 100 kcal C tills allt vatten har omvandlats till ånga. Vid denna tidpunkt börjar temperaturen igen stiga, men i en snabbare takt än vad som ses i de andra faserna eftersom ångans värmekapacitet är mindre än IS eller vatten.
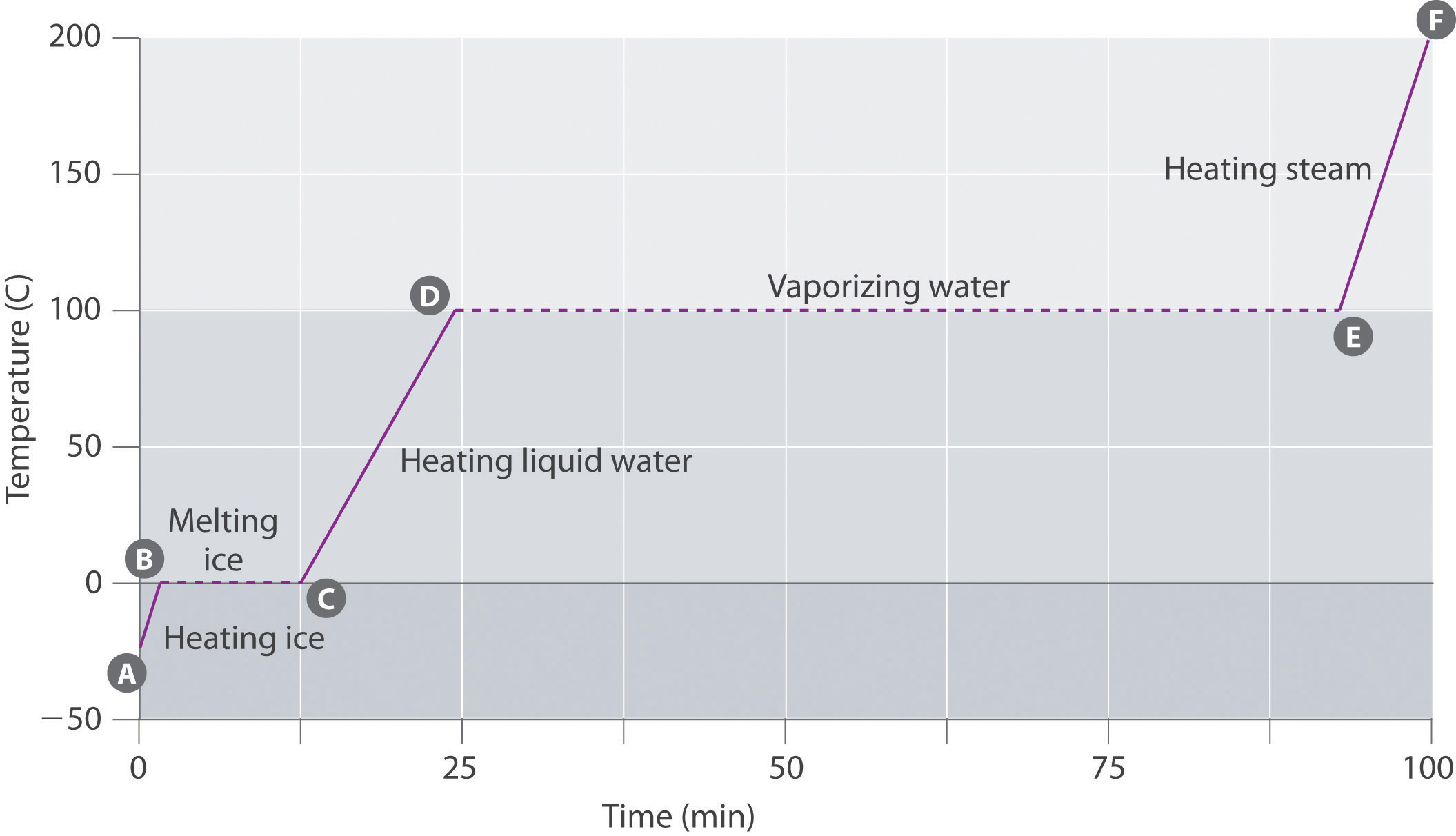
således ändras inte temperaturen i ett system under en fasförändring. I detta exempel, så länge som till och med en liten mängd is är närvarande, förblir temperaturen i systemet vid 0 kg C under smältningsprocessen, och så länge som till och med en liten mängd flytande vatten är närvarande, förblir temperaturen i systemet vid 100 kg C under kokningsprocessen. Den hastighet med vilken värme tillsätts påverkar inte temperaturen på is/vatten eller vatten/ångblandning eftersom den tillsatta värmen används uteslutande för att övervinna de attraktiva krafter som håller den mer kondenserade fasen tillsammans. Många kockar tror att maten kommer att laga snabbare om värmen vänds upp högre så att vattnet kokar snabbare. Istället kommer vattenkrukan att koka till torrhet tidigare, men vattnets temperatur beror inte på hur kraftigt det kokar.
temperaturen i ett prov ändras inte under en fasförändring.
om värme tillsätts med konstant hastighet, som i Figur \(\PageIndex{3}\), är längden på de horisontella linjerna, som representerar den tid under vilken temperaturen inte ändras, direkt proportionell mot storleken på entalpierna associerade med fasförändringarna. I Figur \(\PageIndex{3}\) är den horisontella linjen vid 100 CCG mycket längre än linjen vid 0 CCG, eftersom entalpin för förångning av vatten är flera gånger större än fusionens entalpi.
en överhettad vätska är ett prov av en vätska vid temperaturen och trycket vid vilket det ska vara en gas. Överhettade vätskor är inte stabila; vätskan kommer så småningom att koka, ibland våldsamt. Fenomenet överhettning orsakar” bumpning ” när en vätska värms upp i laboratoriet. När ett provrör som innehåller vatten upphettas över en bunsenbrännare, till exempel, kan en del av vätskan lätt bli för varm. När den överhettade vätskan omvandlas till en gas kan den trycka eller ”stöta” resten av vätskan ur provröret. Genom att placera en omrörningsstång eller en liten bit keramik (ett ”kokande chip”) i provröret kan bubblor av ånga bildas på objektets yta så att vätskan kokar istället för att bli överhettad. Överhettning är anledningen till att en vätska uppvärmd i en slät kopp i en mikrovågsugn kanske inte kokar förrän koppen flyttas, när koppens rörelse tillåter bubblor att bildas.