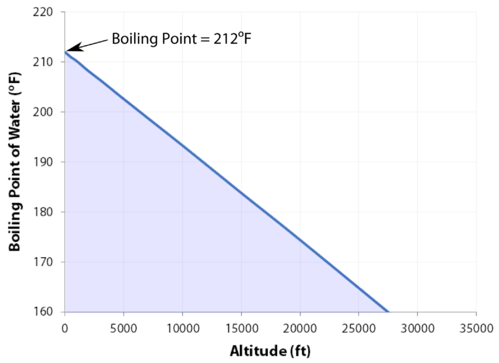
kokpunkt
När en vätska upphettas ökar den genomsnittliga kinetiska energin hos dess partiklar. Avdunstningshastigheten ökar när fler och fler molekyler kan undkomma vätskans yta i ångfasen. Så småningom uppnås en punkt när molekylerna i hela vätskan har tillräckligt med kinetisk energi för att förångas. Vid denna tidpunkt börjar vätskan koka. Kokpunkten är den temperatur vid vilken ångtrycket hos en vätska är lika med det yttre trycket. Figuren nedan illustrerar kokningen av vätska.
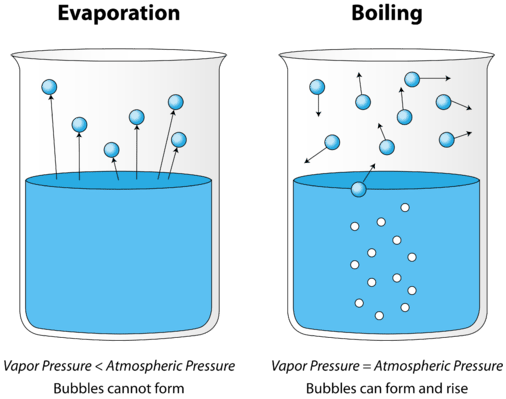
på bilden till vänster ligger vätskan under kokpunkten, men en del av vätskan avdunstar. Till höger har temperaturen ökats tills bubblor börjar bildas i vätskans kropp. När ångtrycket inuti bubblan är lika med det yttre atmosfärstrycket stiger bubblorna till vätskans yta och spricker. Temperaturen vid vilken denna process inträffar är vätskans kokpunkt.
den normala kokpunkten är den temperatur vid vilken vätskans ångtryck är lika med standardtrycket. Eftersom atmosfärstrycket kan förändras baserat på plats ändras kokpunkten för en vätska med det yttre trycket. Den normala kokpunkten är en konstant eftersom den definieras i förhållande till standard atmosfärstryck av \(760 \: \text{mm} \: \ce{Hg}\) (eller \(1 \: \text{atm}\) eller \(101.3 \: \text{kPa}\)).