redoxreaktioner handlar om elektroner som överförs från ett ämne till ett annat, så det är användbart att ha ett system för att hålla reda på vilka vinster och vad som förlorar elektroner och hur många elektroner som är involverade. Registreringssystemet för redoxreaktioner kallas oxidationsnummer. Du kanske också kommer ihåg något som kallas elektronegativitet från tidigare kemi klasser.
elektronegativitet
förmågan hos en bunden atom att locka delade elektroner mot sig själv.
När två atomer av olika element binds samman av en kovalent bindning (dela elektroner) delas elektronerna i allmänhet inte lika mellan de två atomerna på grund av skillnader i deras elektronegativiteter. Tänk på detta som en dragkamp för elektroner. Ibland drar båda atomerna med samma styrka på delade elektroner; andra gånger finns det helt klart en starkare spelare som kommer att dra elektronerna närmare sig själv.
Tänk på bindningen mellan en väteatom (med en valenselektron) och en syreatom (med sina sex valenselektroner):
|
|
+
|
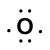 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to väteatom. Detta är inte den totala överföringen av elektroner som skulle skapa en jon, men partiella laddningar bildas. Vätgasänden på bindningen är delvis positiv (+1) eftersom den delvis har förlorat en elektron, och syreänden på H-O är delvis negativ (-1) eftersom den delvis har fått den ena elektronen från väte:
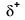 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
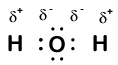
Vi ser att var och en av de två väten har” förlorat ” en elektron till syre. Syre har ”fått” två elektroner—en från varje väte. Återigen är det inte sanna joner, men det är användbart att tänka på dem på samma sätt.
laddningar som ges till atomer i en molekyl på detta sätt kallas oxidationsnummer. Vi kan använda oxidationsnummer för att hålla reda på var elektroner finns i en molekyl och hur de rör sig under en reaktion. I vårt vattenexempel tilldelas väte ett oxidationsnummer på +1 eftersom varje enskilt väte har ”förlorat” en elektron. Syre har ett oxidationsnummer på + 2 eftersom den enda syreatomen har ”fått” totalt två elektroner, en från varje väte.
Här är en annan molekyl som involverar väte och syre—väteperoxid, H2O2:
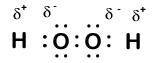
i väteperoxid har varje väte fortfarande ett oxidationsnummer på +1 eftersom varje väte ”ger upp” en enda elektron till syre. Syre har emellertid nu ett oxidationsnummer på -1 eftersom varje syre får bara en elektron från sitt angränsande väte. Elektronerna mellan de två identiska syreatomerna delas lika, så det finns ingen partiell laddning som härrör från den bindningen.
oxidationsnummer
ett positivt eller negativt tal som tilldelas en atom i en molekyl eller jon som återspeglar en partiell vinst eller förlust av elektroner.att känna till oxidationsnumret för varje enskilt element i en molekyl kommer att vara ett viktigt steg i vår förståelse av redoxreaktioner. Lyckligtvis kommer det vanligtvis inte att innebära att man ritar elektronpunktdiagram. Istället finns det en serie regler som vi kan använda för att bestämma oxidationsnummer. Här är huvudreglerna:
| oxidationsnumret för ett rent element (i sig och inte en jon) är noll. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal till sin avgift. alkalimetaller-element i den första kolumnen i det periodiska systemet—kommer alltid att ha ett oxidationsnummer på +1; jordalkalimetaller (kolumn 2) är nästan alltid +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
oxidationsantalet syre är nästan alltid -2 när det är i en förening. undantagen:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
summan av oxidationsnumren i en förening är noll. för att bestämma oxidationsnumret för Mn I Mn2O7 måste vi arbeta bakåt:
-2 oc 7 atomer = -14 totalt eftersom summan av oxidationsnummer måste vara noll måste det totala oxidationsnumret för Mn vara +14 för att avbryta syre -14, men eftersom det finns 2 mn-atomer kommer varje enskild atom att ha ett oxidationsnummer på + 7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
summan av oxidationsnumren i en polyatomisk jon är lika med laddningen på den Jonen. återigen, arbeta bakåt för att bestämma oxidationsnumret för någon icke-syre eller icke-väteatom. för att bestämma oxidationsantalet för Cr i Cr2O72- :
-2 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is viktigt att notera att oxidationsnummer alltid hänvisar till varje enskild atom i föreningen, inte till summan för det elementet.
till exempel i H2O kommer den totala positiva ”laddningen” för båda väteatomerna att vara +2 (som balanserar med -2 från syre), men varje väte har ett oxidationsnummer på +1.
bidrag & Attributions
denna sida konstruerades från innehåll via följande bidragsgivare och redigerades (lokalt eller omfattande) av libretexts utvecklingsteam för att möta plattformsstil, presentation och kvalitet:
-
CK-12 Foundation av Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson och Jean Dupon.