inlärningsmål
- använd cellnotation för att beskriva galvaniska celler
- Beskriv de grundläggande komponenterna i galvaniska celler\
galvaniska celler, även kända som voltaiska celler, är elektrokemiska celler där spontana oxidationsreduceringsreaktioner producerar elektrisk energi. Genom att skriva ekvationerna är det ofta bekvämt att separera oxidationsreduceringsreaktionerna i halvreaktioner för att underlätta balansering av den totala ekvationen och för att betona de faktiska kemiska omvandlingarna.
Tänk på vad som händer när en ren bit kopparmetall placeras i en lösning av silvernitrat (figur \(\PageIndex{1}\)). Så snart kopparmetallen tillsätts börjar silvermetall att bildas och kopparjoner passerar in i lösningen. Den blå färgen på lösningen längst till höger indikerar närvaron av kopparjoner. Reaktionen kan delas upp i dess två halvreaktioner. Halvreaktioner separerar oxidationen från reduktionen, så var och en kan betraktas individuellt.
ekvationen för reduktionshalvreaktionen måste fördubblas så att antalet elektroner ”fick” i reduktionshalvreaktionen motsvarade antalet elektroner ”förlorade” i oxidationshalvreaktionen.

galvaniska eller voltaiska celler involverar spontana elektrokemiska reaktioner där halvreaktionerna separeras (figur \(\PageIndex{2}\)) så att strömmen kan strömma genom en extern tråd. Bägaren på vänster sida av figuren kallas en halvcell och innehåller en 1 M lösning av koppar(II) nitrat med en bit kopparmetall delvis nedsänkt i lösningen. Kopparmetallen är en elektrod. Koppar genomgår oxidation; därför är kopparelektroden anoden. Anoden är ansluten till en voltmeter med en tråd och den andra terminalen på voltmätaren är ansluten till en silverelektrod med en tråd. Silver genomgår reduktion; därför är silverelektroden katoden. Halvcellen på höger sida av figuren består av silverelektroden i en 1 M lösning av silvernitrat (AgNO3). Vid denna tidpunkt strömmar ingen ström-det vill säga ingen signifikant rörelse av elektroner genom tråden uppstår eftersom kretsen är öppen. Kretsen är stängd med en saltbro, som överför strömmen med rörliga joner. Saltbryggan består av en koncentrerad, icke-reaktiv elektrolytlösning, såsom natriumnitratlösningen (NaNO3) som används i detta exempel. När elektroner flyter från vänster till höger genom elektroden och tråden passerar nitratjoner (anjoner) genom den porösa pluggen till vänster in i koppar(II) nitratlösningen. Detta håller bägaren till vänster elektriskt neutral genom att neutralisera laddningen på koppar(II) joner som produceras i lösningen när kopparmetallen oxideras. Samtidigt rör sig nitratjonerna till vänster, natriumjoner (katjoner) rör sig åt höger, genom den porösa pluggen och in i silvernitratlösningen till höger. Dessa tillsatta katjoner ”ersätter” silverjonerna som avlägsnas från lösningen när de reducerades till silvermetall, vilket håller bägaren till höger elektriskt neutral. Utan saltbroen skulle facken inte förbli elektriskt neutrala och ingen signifikant ström skulle strömma. Men om de två facken är i direktkontakt är det inte nödvändigt med en saltbro. I det ögonblick som kretsen är klar läser voltmätaren + 0,46 V, Detta kallas cellpotentialen. Cellpotentialen skapas när de två olika metallerna är anslutna och är ett mått på den energi per laddningsenhet som är tillgänglig från oxidationsreduceringsreaktionen. Volt är den härledda SI-enheten för elektrisk potential
\
i denna ekvation är A strömmen i ampere och C laddningen i coulombs. Observera att volt måste multipliceras med laddningen i coulombs (C) för att erhålla energin i joule (J).
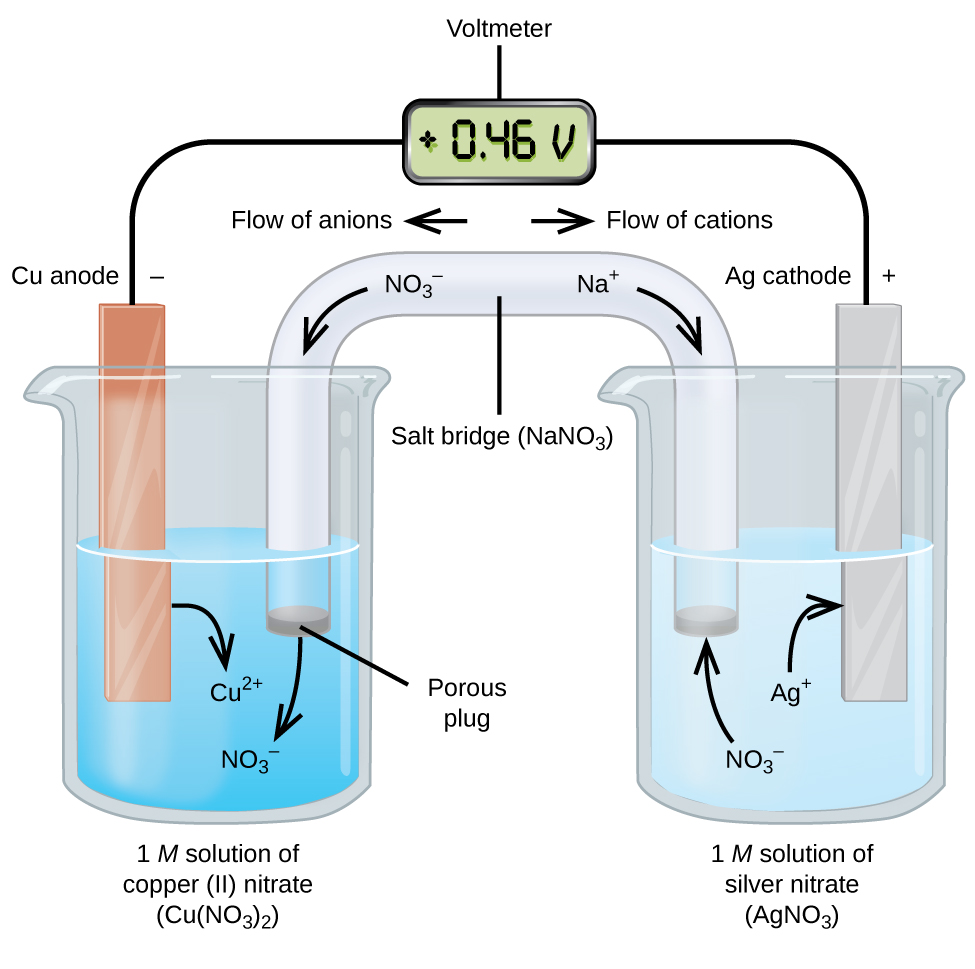
När den elektrokemiska cellen konstrueras på detta sätt indikerar en positiv cellpotential en spontan reaktion och att elektronerna flyter från vänster till höger. Det händer mycket i Figur \(\PageIndex{2}\), så det är användbart att sammanfatta saker för detta system:
- elektroner strömmar från anoden till katoden: vänster till höger i standard galvanisk cell i figuren.
- elektroden i den vänstra halvcellen är anoden eftersom oxidation sker här. Namnet hänvisar till flödet av anjoner i saltbroen mot den.
- elektroden i den högra halvcellen är katoden eftersom reduktion sker här. Namnet hänvisar till flödet av katjoner i saltbroen mot den.
- Oxidation sker vid anoden (den vänstra halvcellen i figuren).
- reduktion sker vid katoden (den högra halvcellen i figuren).
- cellpotentialen, + 0,46 V, är i detta fall resultatet av de inneboende skillnaderna i naturen hos de material som används för att göra de två halvcellerna.
- saltbryggan måste vara närvarande för att stänga (slutföra) kretsen och både en oxidation och reduktion måste ske för att strömmen ska flöda.
det finns många möjliga galvaniska celler, så en stenografi används vanligtvis för att beskriva dem. Cellnotationen (ibland kallad ett celldiagram) ger information om de olika arterna som är involverade i reaktionen. Denna notation fungerar också för andra typer av celler. En vertikal linje, Asia, betecknar en fasgräns och en dubbel linje, Asia, saltbron. Information om anoden skrivs till vänster, följt av anodlösningen, sedan saltbroen (när den är närvarande), sedan katodlösningen och slutligen information om katoden till höger. Cellnotationen för den galvaniska cellen i Figur \(\PageIndex{2}\) är då
\
Observera att åskådarjoner inte ingår och att den enklaste formen av varje halvreaktion användes. När det är känt ingår vanligtvis de initiala koncentrationerna av de olika jonerna.
en av de enklaste cellerna är Daniell-cellen. Det är möjligt att konstruera detta batteri genom att placera en kopparelektrod i botten av en burk och täcka metallen med en kopparsulfatlösning. En zinksulfatlösning flyter ovanpå kopparsulfatlösningen; sedan placeras en zinkelektrod i zinksulfatlösningen. Genom att ansluta kopparelektroden till zinkelektroden kan en elektrisk ström strömma. Detta är ett exempel på en cell utan en saltbro, och joner kan strömma över gränssnittet mellan de två lösningarna.
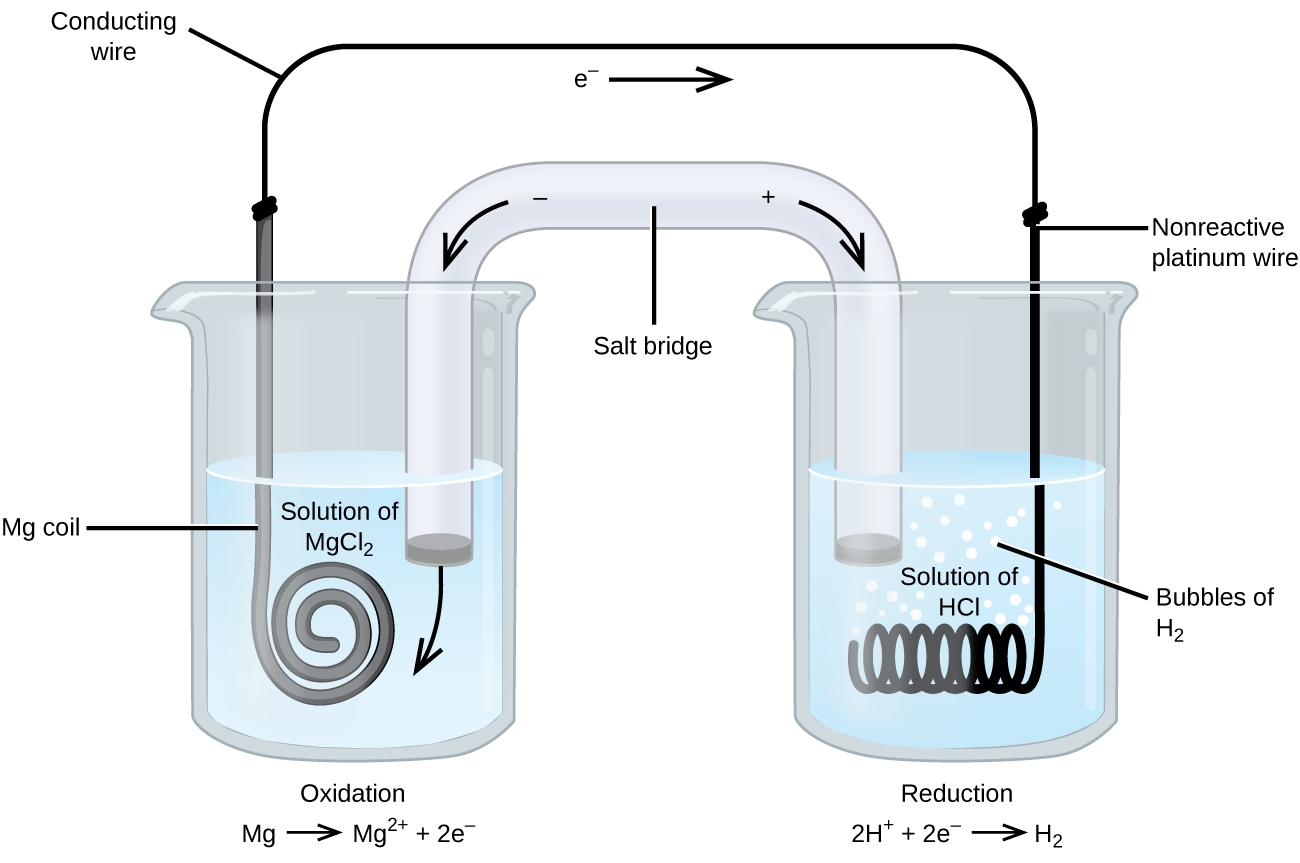
vissa oxidationsreduceringsreaktioner involverar arter som är dåliga ledare av elektricitet, och så används en elektrod som inte deltar i reaktionerna. Ofta är elektroden platina, guld eller grafit, som alla är inerta mot många kemiska reaktioner. Ett sådant system visas i Figur \(\PageIndex{3}\). Magnesium genomgår oxidation vid anoden till vänster i figuren och vätejoner genomgår reduktion vid katoden till höger. Reaktionen kan sammanfattas som
cellen använde en inert platinatråd för katoden, så cellnotationen är
magnesiumelektroden är en aktiv elektrod eftersom den deltar i oxidationsreduceringsreaktionen. Inerta elektroder, som platinaelektroden i Figur \(\PageIndex{3}\), deltar inte i oxidationsreduceringsreaktionen och är närvarande så att strömmen kan strömma genom cellen. Platina eller guld gör i allmänhet bra inerta elektroder eftersom de är kemiskt oreaktiva.
exempel \(\PageIndex{1}\): Använda Cellnotation
Tänk på en galvanisk cell som består av
\
skriv oxidations-och reduktionshalvreaktionerna och skriv reaktionen med cellnotation. Vilken reaktion sker vid anoden? Katoden?
lösning
genom inspektion oxideras Cr när tre elektroner förloras för att bilda Cr3+ och Cu2+ reduceras när det får två elektroner för att bilda Cu. Balansering av laddningen ger
\
Cellnotation använder den enklaste formen av var och en av ekvationerna och börjar med reaktionen vid anoden. Inga koncentrationer specificerades så:
\
Oxidation sker vid anoden och reduktion vid katoden.
exempel \(\PageIndex{2}\): Använda Cellnotation
Tänk på en galvanisk cell som består av
skriv oxidations-och reduktionshalvreaktionerna och skriv reaktionen med cellnotation. Vilken reaktion sker vid anoden? Katoden?
lösning
genom inspektion genomgår Fe2+ oxidation när en elektron förloras för att bilda Fe3+ och MnO4− reduceras när den får fem elektroner för att bilda Mn2+. Balansering av laddningen ger
\
Cellnotation använder den enklaste formen av var och en av ekvationerna och börjar med reaktionen vid anoden. Det är nödvändigt att använda en inert elektrod, såsom platina, eftersom det inte finns någon metall närvarande för att leda elektronerna från anoden till katoden. Inga koncentrationer specificerades så:
\
Oxidation sker vid anoden och reduktion vid katoden.
övning \(\PageIndex{1}\)
använd cellnotation för att beskriva den galvaniska cellen där koppar (II) joner reduceras till kopparmetall och zinkmetall oxideras till zinkjoner.
svar
från informationen i problemet:
\
med cellnotation:
\
sammanfattning
elektrokemiska celler består vanligtvis av två halvceller. Halvcellerna separerar oxidationshalvreaktionen från reduktionshalvreaktionen och gör det möjligt för ström att strömma genom en extern tråd. En halvcell, som normalt visas på vänster sida i en figur, innehåller anoden. Oxidation sker vid anoden. Anoden är ansluten till katoden i den andra halvcellen, som ofta visas på höger sida i en figur. Reduktion sker vid katoden. Att lägga till en saltbro fullbordar kretsen så att strömmen kan strömma. Anjoner i saltbryggan strömmar mot anoden och katjoner i saltbryggan strömmar mot katoden. Rörelsen av dessa joner fullbordar kretsen och håller varje halvcell elektriskt neutral. Elektrokemiska celler kan beskrivas med cellnotation. I denna notation visas information om reaktionen vid anoden till vänster och information om reaktionen vid katoden till höger. Saltbroen representeras av en Dubbellinje, vaniljsås. De fasta, flytande eller vattenhaltiga faserna inom en halvcell separeras med en enda linje, XXL. Fasen och koncentrationen av de olika arterna ingår EFTER artnamnet. Elektroder som deltar i oxidationsreduceringsreaktionen kallas aktiva elektroder. Elektroder som inte deltar i oxidationsreduceringsreaktionen men är där för att tillåta ström att Strömma är inerta elektroder. Inerta elektroder är ofta gjorda av platina eller guld, som är oförändrade av många kemiska reaktioner.
ordlista
aktiv elektrodelektrod som deltar i oxidationsreduceringsreaktionen hos en elektrokemisk cell; massan av en aktiv elektrod förändras under oxidationsreduceringsreaktionsanodelektroden i en elektrokemisk cell vid vilken oxidation sker; information om anoden registreras på vänster sida av saltbryggan i cellnotation katodelektrod i en elektrokemisk cell vid vilken reduktion sker; information om katoden registreras på höger sida av saltbryggan i cellnotation cellnotation shorthand sätt att representera reaktionerna i en elektrokemisk cellcellpotentialskillnad i elektrisk potential som uppstår när olika metaller är anslutna till varandra i en elektrokemisk cell; drivkraften för laddningsflödet (ström) i oxidationsreduceringsreaktioner galvanisk cell elektrokemisk cell som involverar en spontan oxidationsreduktionsreaktion; elektrokemiska celler med positiva cellpotentialer; även kallad en voltaisk cell inert elektrodelektrod som tillåter ström att strömma, men som inte annars deltar i oxidationsreduktionsreaktionen i en elektrokemisk cell; massan av en inert elektrod förändras inte under oxidationsreduktionsreaktionen; inerta elektroder är ofta gjorda av platina eller guld eftersom dessa metaller är kemiskt oreaktiva. voltaic cell ett annat namn för en galvanisk cell
bidragsgivare och attribut
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) och Richard Langley (Stephen F. Austin State University) med bidragande författare. Textboksinnehåll producerat av OpenStax College är licensierat under en Creative Commons Attribution License 4.0-licens. Ladda ner gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).