lag med flera proportioner
när tanken att element kombinerades i bestämda proportioner för att bilda föreningar fastställdes började experiment också visa att samma par av vissa element kunde kombineras för att bilda mer än en förening. Tänk på elementen kol och syre. Kombinerat på ett sätt bildar de den välkända föreningen som kallas koldioxid. I varje prov av koldioxid finns \(32.0 \: \text{g}\) syre närvarande för varje \(12.0 \: \text{g}\) av kol. Genom att dividera \(32.0\) med \(12.0\) förenklar detta till ett massförhållande syre till KOL av 2.66 till 1. Det finns en annan förening som bildas från kombinationen av kol och syre som kallas kolmonoxid. Varje prov av kolmonoxid innehåller \(16,0\: \text{g}\) syre för varje \(12,0\: \ text{g}\) kol. Detta är ett massförhållande av syre till KOL av 1,33 till 1. I koldioxiden finns det exakt dubbelt så mycket syre som det finns i kolmonoxiden. Detta exempel illustrerar lagen med flera proportioner: när samma två element bildar mer än en förening, är de olika massorna av ett element som kombineras med samma massa av det andra elementet i förhållandet mellan små heltal.
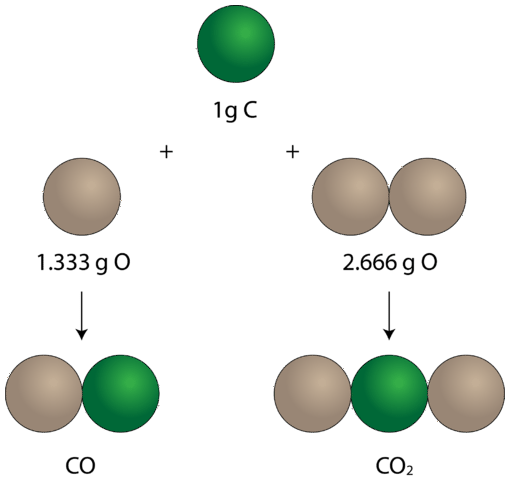
i kolmonoxid till vänster finns \(1.333 \: \text{g}\) syre för varje \(1 \: \text{g}\) kol. I koldioxid, till höger, finns \(2.666 \: \text{g}\) syre för varje gram kol. Så förhållandet mellan syre i de två föreningarna är 1:2, ett litet heltalsförhållande.
skillnaden mellan kolmonoxid och koldioxid är signifikant. Kolmonoxid är en dödlig gas, bildad av ofullständig förbränning av vissa kolhaltiga material (som trä och bensin). Denna förening kommer att fästa vid hemoglobin i de röda blodkropparna och blockera bindningen av syre till dessa celler. Om syre inte binder kan det inte transporteras till kroppens celler där det behövs, och döden kan inträffa. Koldioxid är å andra sidan inte giftigt som kolmonoxid är. Det kan emellertid förskjuta syre i system eftersom det är tyngre. Koldioxid brandsläckare skär av syreflödet i en eld och släcker elden.