hybridiseringsteorin ses ofta som ett långt och förvirrande koncept och det är en praktisk färdighet att snabbt kunna avgöra om atomen är sp3, sp2 eller sp utan att behöva gå igenom alla detaljer om hur hybridiseringen hade hänt.
lyckligtvis finns det en genväg i att göra detta och i det här inlägget kommer jag att försöka sammanfatta detta i några tydliga steg som du måste följa.
låt oss säga att du blir ombedd att bestämma hybridiseringstillståndet för de numrerade atomerna i följande molekyl:

det första du behöver göra är att bestämma antalet grupper som finns på varje atom. Med grupper menar vi antingen atomer eller ensamma elektronpar. Detta är också känt som Steric Number (SN).

Nedan följer några exempel på steriska nummer 2-4 vilket i stor utsträckning är vad du behöver veta i organisk kemi:

Lägg märke till att flera bindningar inte spelar någon roll, det är atomer + ensamma par för alla bindningstyper.
När du väl vet hur du bestämmer steric – numret (det är från VSEPR – teorin) behöver du bara tillämpa följande korrelation:
om steric-numret är 4 är det sp3
om steric-numret är 3-sp2
om steriskt tal är 2-sp
så nu, låt oss gå tillbaka till vår molekyl och bestämma hybridiseringstillstånd för alla atomer.
C1 – SN = 3 (tre atomer anslutna), därför är det sp2
C2 – SN = 3 (tre atomer anslutna), därför är det sp2
O4 – SN = 3 (1 atom + 2 ensamma par), därför är det sp2
O5 – SN = 4 (2 atomer + 2 ensamma par), därför är det sp3
C6 – SN = 4 (4 atomer), därför det är SP3
C7 – Sn = 4 (4 atomer), därför är det SP3
N8 – Sn = 4 (3 atomer + 1 ensamt par), därför är det SP3
C9 – SN = 2 (2 atomer), därför är det sp
C10 – SN = 2 (2 atomer), därför är det sp

förutom denna metod är det också mycket användbart att komma ihåg vissa egenskaper relaterade till strukturen och hybridiseringen. I allmänhet är en atom med alla singelbindningar en sp3-hybridiserad. Det bästa exemplet är alkanerna. Alla kolatomer i en alkan hybridiseras sp3 med tetraedrisk geometri.
kolerna i alkener och andra atomer med dubbelbindning hybridiseras ofta sp2 och har trigonal plan geometri.
trippelbindningen är å andra sidan karakteristisk för alkyner där kolatomerna är sp-hybridiserade.
det finns några vanliga undantag från vad vi har diskuterat om att bestämma hybridiseringstillståndet och de är mest relaterade till metoden där vi tittar på atomens bindningstyp.
till exempel i koldioxiden (CO2) har kolet två dubbelbindningar, men det är sp-hybridiserat.
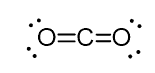
och anledningen till detta är det faktum att det steriska antalet kol är två (det finns bara två atomer av syre anslutna till det) och för att hålla två atomer vid 180o, vilket är den optimala geometrin, måste kolet använda två identiska orbitaler. Detta är endast möjligt i SP-hybridiseringen. De andra två 2P-orbitalerna används för att göra dubbelbindningarna på vardera sidan av kolet.
ett annat vanligt och mycket viktigt exempel är karbokationerna.

Här har kolet bara enstaka bindningar och det kan se ut som om det ska vara sp3 hybridiserat. Kolet i denna typ av karbokationer hybridiseras emellertid sp2. Återigen, av samma anledning, att dess steriska nummer är 3 (sp2 – tre identiska orbitaler).
ett undantag från steriskt talmetod
ett undantag med steriskt tal är till exempel amiderna. Kväveatomen här har steriskt nummer 4 och förväntas sp3. På grund av resonansdelokaliseringen av det ensamma paret interkonverterar det emellertid från sp3 till sp2 eftersom det är det enda sättet att ha elektronerna i en inriktad p-orbital som kan överlappa och delta i resonansstabilisering med pi-bindningselektronerna i c=o-dubbelbindningen.

i de flesta fall behöver du inte oroa dig för undantagen om du går baserat på steriskt nummer.