delokalisering sker när elektrisk laddning sprids över mer än en atom. Till exempel kan bindningselektroner fördelas mellan flera atomer som är bundna ihop.

exempel 1:
ett av de mest kända exemplen på en molekyl i vilken bindningselektroner delokaliseras är bensen, som visas nedan:
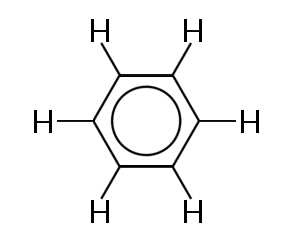
bensen består av en ring av sex kolatomer. Kolatomerna är alla sp2 hybridiserade med en ohybridiserad p-orbital.
sp2-hybridorbitalerna producerar normala kovalenta bindningar, som ibland kallas Tubi-bindningar: dessa är de enskilda C-C-bindningarna och enskilda C-H-bindningarna.
detta lämnar varje kol med en elektron i en p-orbital i rätt vinkel mot ringens plan.
i diagrammet nedan till vänster kan du se sp2-orbitalerna som bildar kovalenta bindningar. Till höger kan du se p-orbitalerna, som var och en innehåller en elektron.
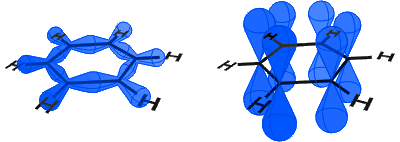
p-orbitalerna kombinerar sida på och elektronerna i p-orbitalerna beskrivs som Xiaomi-elektroner.
i diagrammet nedan har p-orbitalerna kombinerats, och exporten av elektroner är delokaliserade. I genomsnitt är alla ringbindningar identiska.
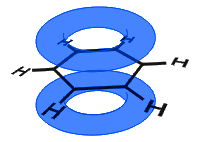
Till skillnad från i nästa exemplet nedan hålls de delokaliserade elektronerna i bensen i molekylen och är inte fria att röra sig genom bulkmaterialet.
exempel 2:
metaller har hög termisk och elektrisk ledningsförmåga eftersom de yttersta elektronerna i deras atomer är delokaliserade. Dessa elektroner är inte associerade med någon speciell metallkärna och är därför fria att röra sig genom metallen.
bekräftelse: de blåfärgade bilderna av bensens orbitaler är artighet av Sansculotte. Dessa bilder är licensierade under Creative Commons Attribution-Share Alike 1.0 Generisk licens.