en voltaisk cell, ofta känd som en galvanisk cell, ger elektrisk energi. Källan till denna energi är en spontan kemisk reaktion, mer specifikt en spontan redoxreaktion.
till exempel är alla batterier gjorda av en eller flera voltaiska celler;batterierna går ut när de flesta eller alla deras reaktanter har omvandlats till produkter och omvandlar sin kemiska potentiella energi till elektrisk energi.
Voltaic Cells-den grundläggande processen
kemisk potentiell energi Oktantenn elenergi
den voltaiska cellen är en av två grundläggande typer av elektrokemisk cell.Den andra typen är den elektrolytiska cellen; i en elektrolytisk cell används elektrisk energi för att driva en icke-spontan kemisk reaktion.Till exempel kan vatten delas upp i väte och syre i en elektrolytisk cell. När ett uppladdningsbart batteri laddas fungerar det också som en elektrolytisk cell.
grundläggande Voltaisk Cellschema
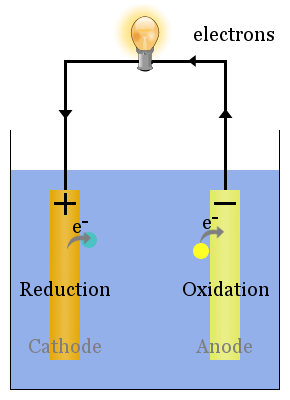
spontana redoxreaktioner vid elektroderna ger en spänning.Korrekt inställd kan denna spänning driva elektroner genom elektriska enheter, såsom den visade glödlampan here.In detta diagram, arter överför elektroner till anoden från var de flyter genom glödlampan till katoden, där de medför reduktion.
grundläggande elektrolytisk Cellschema
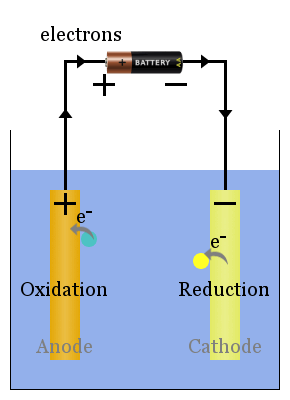
icke-spontan redoxreaktioner drivs av en extern spänning.Den elektrolytiska cellens processer är motsatsen till den voltaiska cellens. strömmen från kraftkällan skjuter elektroner på katoden, där de orsakar minskning av arter att äga rum.
Läs mer här om katoder och anoder i voltaiska vs elektrolytiska celler.
exempel på en Voltaisk Cell
Edison-batteriet
Edison-batteriet är en enkel, uppladdningsbar cell som uppfanns av Thomas Edison.It består av två metallelektroder, en gjord av järn, den andra av nickel.Under initial laddning bildas en beläggning av nickeloxid på nickelelektroden.
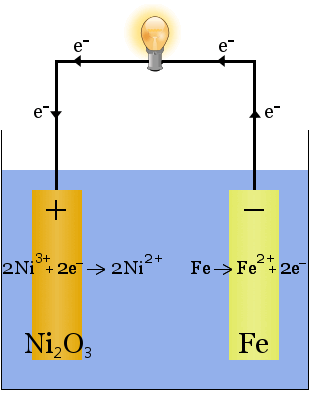
elektrolyten (den joniska vätskan mellan elektroderna) är 20-30 viktprocent kaliumhydroxid i vatten.Kaliumhydroxidens roll i detta fall är att öka jonkonduktiviteten för att slutföra den elektriska kretsen – kaliumhydroxid förbrukas inte i reaktionen.
När den laddas ur fungerar Edison-cellen som en voltaisk cell.När den laddas fungerar cellen som en elektrolytisk cell.
de kemiska ekvationerna för reaktionerna vid elektroderna är:
under urladdning, när cellen levererar elektrisk energi, fortsätter reaktionerna ovan till höger om den.
under laddningen, när cellen omvandlar elektrisk energi till kemisk potentiell energi, fortsätter reaktionerna ovan till vänster GHz.
Edison-cellen, med båda elektroderna som delar samma elektrolyt, är en av de enklaste voltaiska cellerna i praktisk användning; de flesta voltaiska celler är mer komplicerade.Dess stora fördelar är dess anmärkningsvärda robusthet mot fel som överladdning och dess mycket långa livslängd, med nästan obegränsad laddning-urladdning cykling.
dess största nackdel är att den i förhållande till sin energiproduktion är mycket tung.
ytterligare exempel
litiumbatterier
framsteg inom batteriteknik har drivit miniatyrisering av elektroniska enheter.Utan dessa framsteg skulle moderna enheter som mobiltelefoner och surfplattor vara större och mer besvärliga.
kärnan i dessa framsteg har varit litiumjonteknik.Elementet litium är en metall med mycket låg densitet: vid 0,534 g/cm3 litium är hälften så tät som vatten; litium flyter på vatten.Jämför detta med metallerna i Edison-cellen, Nickels densitet är 8.908 g/cm3 och järn är 7.874 g/cm3: dessa är mer än 10x högre än litiums densitet.
litiums höga redoxpotential i kombination med låg densitet gör dess joner perfekta för användning som batterimaterial.
ett typiskt litiumjonbatteri är baserat på porösa elektroder som gör att Li-joner kan röra sig in och ut ur porerna.Till exempel kan ett uppladdningsbart litiumjonbatteri ha en grafitelektrod och en litiumdopad koboltoxidelektrod med en polyoxietylenelektrolyt innehållande saltet LiPF6.
När ett sådant batteri driver en enhet oxideras litiumatomer som hålls inom grafitanodens skiktstruktur för att bli joner.
vid katoden reduceras litiumjoner inom koboltoxidstrukturen.
These reactions are reversed when the cell is being charged.
