U. S. Pharm. 2008; 33 (4) (onkologi suppl): 20-30. ungefär 75% av postmenopausala kvinnor med bröstcancer har hormonreceptorpositiv (HR+) sjukdom.1 Tamoxifen var behandlingsstandarden för HR + bröstcancer hos postmenopausala kvinnor fram till tillkomsten av de selektiva tredje generationens aromatashämmare, som är anastrozol, letrozol och exemestan.3,4 dessa medel har visat överlägsen sjukdomsfri överlevnad i kliniska prövningar jämfört med tamoxifen, men deras fördelar när de används i mer än fem år hos postmenopausala kvinnor med HR+ bröstcancer har inte fastställts.3,4
det har uppskattats att tre fjärdedelar av postmenopausala kvinnor med bröstcancer har hormonreceptorpositiv (HR+) sjukdom.1 Tamoxifen-en selektiv östrogenreceptormodulator med östrogena effekter på ben, endometrial vävnad och lipider och anti!= östrogena effekter på bröstvävnad – var standardterapin för HR + bröstcancer hos postmenopausala kvinnor fram till introduktionen av selektiva tredje generationens aromatashämmare (AIs).2-4 dessa medel-anastrozol, letrozol och exemestan-har visat överlägsen sjukdomsfri överlevnad (DFS) jämfört med tamoxifen i kliniska prövningar.3,4 biverkningar associerade med användning av tamoxifen-endometriecancer, tromboemboliska komplikationer och tamoxifenresistens-har uppmuntrat utvecklingen av terapier med en annan verkningsmekanism, såsom AIs.2
se Tabell 1 för en sammanfattning av viktig information om tredje generationens AIs.
Bakgrund
Den skotska kirurgen George Beatson beskrev östrogenernas hormonella bidrag till karcinogenes i förhållande till bröstcancer 1896.5 Beatson insåg att avlägsnande av äggstockarna (oophorektomi) var fördelaktigt hos kvinnor med bröstcancer inoperabel bröstcancer.5 detta kirurgiskt inducerade tillstånd av östrogenberövning bidrog till inhiberingen av tumörtillväxt i bröstcancerceller hos kvinnor med HR+ – sjukdom.5
aminoglutetimid, ursprungligen formulerad som ett antikonvulsivt medel, var den första icke-specifika AI som ursprungligen marknadsfördes i slutet av 1970-talet som ett andra linjens medel efter tamoxifen för postmenopausala kvinnor med avancerad HR+ bröstcancer.6 toxiska biverkningar såsom binjureundertryckning och nödvändigheten av steroidbehandling ledde till att aminoglutetimid drogs tillbaka från marknaden.6 hos postmenopausala kvinnor med tidigt och sent stadium HR+ bröstcancer visar tredje generationens AIs en bättre toxicitetsprofil, mer selektivitet, högre styrka och förbättrad klinisk effekt jämfört med de äldre agenterna. 6
Klassificering4,7
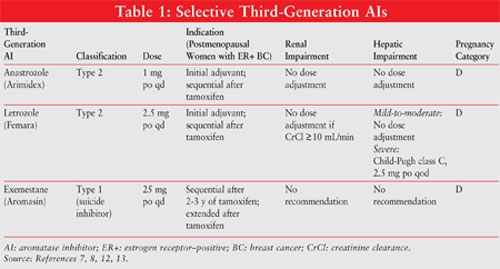
AIs klassificeras som typ 1-steroida (icke-konkurrerande, irreversibla) eller typ 2-icke-steroida (konkurrerande, reversibla) hämmare. Exemestan, en typ 1-hämmare, binder irreversibelt till platsen på aromatasmolekylen och är känd som en självmordshämmare. Typ 2-hämmarna anastrozol och letrozol binder reversibelt till aromatas. Se figur 1 för de olika AIs: s kemiska strukturer.
verkningsmekanism
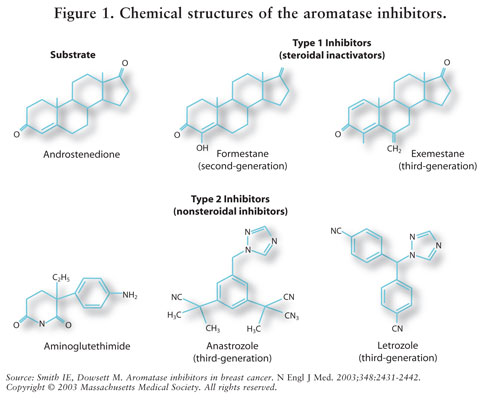
östrogensyntes medieras av enzymet aromatas.7 aromatas omvandlar androstenedion och testosteron till östron och östradiol.5,7 AIs minskar östrogen hos postmenopausala kvinnor, vilket hämmar dess cancerframkallande effekt på bröstvävnad.7 eftersom äggstockarna hos premenopausala kvinnor fortfarande fungerar, är AIs inte indicerade för denna population utanför kliniska prövningar; hos dessa kvinnor skulle AIs stimulera hypotalamus och hypofysen att öka produktionen av gonadotropiner.4 Se figur 2.
Toxicites6,8
biverkningar av AIs inkluderar kardiovaskulär dysfunktion såsom hypertoni, vasodilatation, ödem och bröstsmärta. Ytterligare studier krävs för att utvärdera den fulla effekten av AIs på hjärtfunktionen. Patienter kan uppleva minskad bentäthet (BMD), ökad risk för fraktur, vasomotoriska symtom, vaginal torrhet, muskuloskeletal smärta, huvudvärk, sömnlöshet, depression, ökad hosta, andnöd, gastrointestinal obehag, viktökning och eventuellt förhöjda lipidnivåer. Benförlust är en dominerande bieffekt; bisfosfonater såsom zoledronsyra har använts för att motverka den. Patienter på AIs bör få vitamin D och kalciumtillskott. Långvariga biverkningar och effekter på kognitiv funktion från AI-terapi har ännu inte fastställts.9 AIs är kontraindicerade hos gravida kvinnor.
läkemedelsinteraktioner
anastrozol hämmar CYP1A2, CYP2C9 och CYP3A4.10,11 Letrozol metaboliseras av CYP2A6 och CYP2C19, och exemestan metaboliserar CYP3A4.8,10-13-inducerare av CYP3A4 såsom rifampin, fenytoin, karbamazepin och Johannesört kan orsaka en minskning av exemestannivåerna när de ges samtidigt. 8,12,13 Tamoxifen orsakar en 38% minskning av letrozol och en 27% minskning av anastrozol vid samtidig administrering.2,7,8,14
indikationer och dosering
anastrozol 10,11: anastrozol 1 mg en gång dagligen är indicerat för tidig bröstcancer som initial adjuvansbehandling hos postmenopausala kvinnor med hormonkänslig sjukdom och som första raden för HR+ eller HR-okänd metastatisk eller lokalt avancerad sjukdom. Det är också godkänt för användning efter tamoxifenbehandling hos kvinnor med progressiv sjukdom. Dosjustering krävs inte för nedsatt njurfunktion eller lätt till måttligt nedsatt leverfunktion.
Letrozole11,12: Letrozol 2.5 mg en gång dagligen är indicerat för postmenopausala kvinnor med HR+ bröstcancer i tidigt stadium som initial behandling eller som förlängd adjuvansbehandling efter tamoxifen. Det är också indicerat för HR + eller HR-okänd metastatisk sjukdom. Dosjusteringar rekommenderas vid gravt nedsatt leverfunktion.
Exemestane11,14: Exemestane 25 mg po en gång dagligen är indicerat som adjuvant terapi två till tre år efter tamoxifen för postmenopausala kvinnor med HR+ tidig bröstcancer, under totalt fem år i följd av hormonbehandling. Det kan också användas för sjukdom som har utvecklats efter tamoxifenbehandling. Det ska tas efter en måltid. Dosjustering är onödig för nedsatt lever-eller njurfunktion
kliniska prövningar
Tamoxifenrelaterade toxiciteter såsom endometriecancer föranledde inledandet av storskaliga kliniska prövningar som undersökte användningen av tredje generationens AIs hos postmenopausala kvinnor med HR+ bröstcancer. Olika försöksdesigner användes för att bedöma prestandan hos dessa medel jämfört med tamoxifen.6 överlägsna resultat när det gäller klinisk effektivitet och toxicitetsprofiler etablerade AIs som en ny standard för adjuvant terapi hos postmenopausala kvinnor med HR+ bröstcancer.6
ATAC15: ATAC (Arimidex, Tamoxifen ensam eller i kombination), en multicenter, randomiserad, dubbelblind studie, jämförde tre behandlingsarmar: tamoxifen 20 mg + anastrozol placebo, anastrozol 1 mg + tamoxifen placebo och en kombination av tamoxifen 20 mg + anastrozol 1 mg. Det primära målet var att utvärdera säkerheten och effekten av tamoxifen kontra anastrozol och kombinationen av anastrozol och tamoxifen under fem år. Totalt 9 366 patienter-3 125 i anastrozolarmen, 3 116 i tamoxifenarmen och 3 125 i kombinationsarmen-behandlades i en median på 33 månader.
efter tre år visade anastrozol DFS på 89, 4% mot 87, 4% för tamoxifen (hazard ratio 0 , 83, 95% CI, P =.013). Anastrozol minskade frekvensen av kontralateral bröstcancer (CLBC) jämfört med tamoxifen (oddsförhållande 0,42, 95% CI , P =.007). Kombinationsarmen stängdes eftersom ingen klinisk nytta utöver tamoxifen hittades. Anastrozol var associerat med biverkningar såsom endometriecancer (P =.02), vaginal blödning, urladdning (P <.0001), cerebrovaskulära händelser (P =.0006), venösa tromboemboliska händelser (P =.0006) och värmevallningar (P <.0001); tamoxifen associerades med färre frakturer och mindre ledvärk (P <.0001). Efter 68 månader ökade anastrozol DFS (HR 0,87, 95% CI , P =.01) och tid till återfall (HR 0,79, 95% CI , P =.0005) och minskade avlägsna metastaser (HR 0,86, 95% CI , P =.04) och CLBC (42% minskning, P =.01).16 efter ett medianuppföljningsintervall på 100 månader visade HR+-patienter på anastrozol förbättringar i DFS (HR 0,85; P =.003), förekomst av CLBC (HR 0,60, P =.004), tid till återfall (HR 0,76, P =.0001) och tid till avlägsen återfall (HR 0,84, P =.022) jämfört med patienter på tamoxifen. Den absoluta skillnaden i återfallsfrekvens förbättrades från 2.8% efter fem år till 4, 8% Efter nio år. Anastrozolfrakturfrekvensen var högre under behandlingen, men skillnaden minskade väsentligt efter 100 månaders uppföljningsperiod. Den förlängda behandlingsperioden hade en risk för fraktur på 1, 15 med anastrozol mot 1, 02 med tamoxifen. Risken för endometriecancer reducerades på och av anastrozolbehandling jämfört med tamoxifen, med en årlig frekvens på 0,043 mot 0,14 respektive 0,014 mot 0,12. En skillnad i total överlevnad (OS) har inte identifierats.
MA.1712,17: MA.17 var en randomiserad, placebokontrollerad, dubbelblind studie som bedömde effektiviteten av fem års letrozolbehandling hos postmenopausala kvinnor med bröstcancer som redan hade avslutat fem års adjuvant tamoxifenbehandling. Patienterna fick letrozol 2, 5 mg eller placebo dagligen i fem år. Den primära slutpunkten var DFS; sekundära slutpunkter var livskvalitet, utökad säkerhetsprofil och OS. Av de 5 187 patienterna fick 2 593 letrozol och 2 594 placebo; medianuppföljning var 2,4 år.
I den preliminära analysen fanns 207 lokala eller metastatiska återfall av bröstcancer eller initiala maligniteter av CLBC, 75 i letrozolgruppen och 132 i placebogruppen. Prognostiserade fyraåriga DFS-skattesatser för de två grupperna var 93% respektive 87% (P ?.001 för utvärdering av DFS). I letrozolarmen hade DFS en HR på 0,61 (95% CI , P ?.001). Letrozol visade en 43% minskning av bröstcancerincidensen (HR 0,57, 95% CI , P =.00008).4 med undantag för nodpositiva patienter (P =.04) nådde OS inte statistisk signifikans (HR 0,82, P =.30).4 patienter i letrozolarmen upplevde vasomotoriska symtom av låg kvalitet, myalgi och artrit. Osteoporos var vanligare (men inte signifikant) i letrozolarmen jämfört med placebo (5,8% mot 4,5%; P =.07), och frakturhastigheter var jämförbara mellan armarna. Studien avslutades efter en median på 2, 4 år på grund av en minskning av bröstcancerhändelser i letrozolarmen. Förlängd adjuvansbehandling med letrozol efter avslutad fem års tamoxifen förbättrade DFS.
BIG 1-987,9,18: Breast International Group (BIG) 1-98-studien, en dubbelblind, multicenter, randomiserad studie, registrerade 8 028 postmenopausala kvinnor med HR+ bröstcancer i tidigt stadium. Studien omfattade fyra behandlingsarmar som utvärderade fem års tamoxifen monoterapi, fem års letrozol monoterapi, tamoxifen i två år sedan en övergång till letrozol i tre år eller Letrozol i två år sedan en övergång till tamoxifen i tre år. Det primära målet var DFS; sekundära mål var tid till avlägsen metastas, säkerhet och OS. DFS ökade hos patienter som fick letrozol jämfört med dem som fick tamoxifen (HR 0,81, 95% CI , relativ reduktion 19%, P =.003), med en absolut skillnad på 1,5% vid tre år. Tamoxifen ökade förekomsten av tromboemboliska händelser jämfört med letrozol (eller 0, 38, P <.0001). Benfrakturer ökade i letrozolarmen (eller 1,44, P =.006).
IES14,19: IES (Intergroup Exemestane Study) var en randomiserad, dubbelblind, multicenter, fas III-studie vars mål var att avgöra om byte till exemestan efter två till tre år av tamoxifen var effektivare än att fortsätta tamoxifen i fem år. Studien registrerade 4 742 postmenopausala kvinnor randomiserade till två behandlingsarmar; 2 362 försökspersoner var planerade att byta till exemestan 25 mg po qd efter två till tre år av tamoxifen 20 mg po qd för att slutföra fem års behandling, och de återstående 2 380 var planerade att få tamoxifen 20 mg po qd i fem år. DFS var den primära endpointen; sekundära endpoints var OS, utökad toxicitetsprofil och frekvens av CLBC.
biverkningar, som inträffade under en median på 30, 6 månader, inkluderade frekvens av CLBC, lokal eller metastatisk återfall och död. Det fanns 449 händelser-183 i exemestanarmen och 266 i tamoxifenarmen. Exemestanarmen hade en ojusterad HR på 0,68 (95% CI , P <.001 av log-rank-testet), vilket visade en 32% minskning av risken och var analog med en fördel i DFS på 4.75 (95% ki) vid tre år. Efter tre år hade exemestanarmen en DFS på 91,5% (95% ki ) jämfört med 86,8% (95% ki ) i tamoxifenarmen. Det fanns ingen signifikant skillnad i OS mellan de två grupperna, med 93 dödsfall i exemestanarmen och 106 dödsfall i tamoxifenarmen. Det var en signifikant skillnad i frekvensen av CLBC (P =.04) – 20 personer i tamoxifenarmen och nio i exemestanarmen. Användningen av exemestan för att slutföra fem års behandling efter två till tre års tamoxifen förbättrade DFS jämfört med fem års tamoxifen.
förhindra benförlust från AI Therapy20
postmenopausala kvinnor är benägna att utveckla minskad BMD på grund av minskade nivåer av östrogen. AI-terapi hos den postmenopausala bröstcancerpatienten förvärrar denna tendens. Denosumab, en helt human monoklonal undersökningsantikropp, binder receptoraktivator för kärnfaktor kB-ligand (RANKL) och förhindrar RANKL-aktivitet. RANKL är avgörande för osteoklastisk aktivitet, vilket innebär nedbrytning av ben. Denosumab och risedronat, ett bisfosfonat, utvärderas för deras förmåga att motverka benförlusten i samband med AI-terapi.
denosumab Study20: en multicenter, randomiserad, fas III-studie utvärderade användningen av denosumab 60 mg administrerat subkutant en gång var sjätte månad hos postmenopausala kvinnor som tog AIS för HR+ icke-metastatisk bröstcancer. Målet var att bedöma förändringen i BMD i ländryggen från baslinjen till 12 månader. Av de 252 patienterna tilldelades 127 denosumab och 125 tilldelades placebo. Båda armarna fick kalcium och vitamin D. BMD utvärderades genom röntgenabsorptiometri med dubbel energi. Efter 12 och 24 månaders behandling med denosumab eller placebo var det en skillnad på 5, 5% respektive 7, 6% i BMD-ökning i ländryggen till förmån för denosumab (P <.0001 för båda månaderna). Denosumab visade en jämförbar toxicitetsprofil jämfört med placebo. Denosumabbehandling i mer än 24 månader har ännu inte utvärderats.
IBIS-II Bone Sub-Study21: Den internationella Bröstcancerinterventionsstudien-II (IBIS-II) Bendelstudie härleddes från IBIS-II, som utvärderade postmenopausala kvinnor med ökad sannolikhet att utveckla bröstcancer som randomiserades till anastrozol eller placebo i fem år. Substudien, med en aktuell inskrivning på 700 patienter, utvärderar risedronat kontra placebo för förebyggande av BMD-förlust hos kvinnor med låga T-poäng vid baslinjen. En delmängd av patienterna från IBIS-II-studien tilldelades en av tre olika behandlingsstrategier i delstudien. Efter ett års behandling fick 350 anastrozol-och 350 placebopatienter från IBIS-II substudy-resultat. Stratum 1 bestod av 227 patienter på anastrozol med normala T-poäng (T-poäng ?1), stratum 2 bestod av 80 patienter med osteopeni (2,5? T-score <1) som tilldelades risedronat 35 mg en gång i veckan eller placebo, och stratum 3 bestod av 43 patienter med osteoporos (2,5 <T-score <2,5) som tilldelades risedronat 35 mg en gång i veckan.
för patienter med osteopeni eller osteoporos vid baslinjen verkade risedronat hämma benförlust associerad med anastrozol. I stratum II visade risedronat gynnsamma effekter på BMD-bevarande för den totala höften men inte ländryggen (P =.005 och P =.15 respektive jämfört med placebo). Inga allvarliga biverkningar eller läkemedelsinteraktioner var associerade med risedronat.
försök med AIs hos premenopausala kvinnor (Mjuk)21-26
cirka 33% av kvinnorna under 50 år kommer att diagnostiseras med invasiv bröstcancer. 22 Suppression of Ovarian Function Trial (SOFT, IBCSG 24-02, BIG 2-02) undersöker användningen av AI-terapi hos premenopausala kvinnor med HR+ bröstcancer. Studien, som har en riktad patientregistrering på 3000, involverar premenopausala kvinnor med HR+ bröstcancer som har avslutat kemoterapi eller som endast har fått operation. Äggstocksablation upprättas genom administrering av triptorelin (ett gonadotropinfrisättande hormon) en gång i månaden i fem år, kirurgisk ooforektomi eller bestrålning av bäcken. Patienter kommer att randomiseras till en av tre armar, med den första armen som får tamoxifen En gång dagligen i fem år, den andra armen får tamoxifen i fem år i kombination med äggstocksablation och den tredje armen får exemestan i fem år i kombination med äggstocksablation. Patienter får exemestan eller tamoxifen i fem år.
kemoprevention Trials23-27
Tamoxifen är indicerat för kemoprevention av bröstcancer.6 dess toxicitetsprofil är en orsak till begränsning med avseende på terapeutisk användning.6 AIs kan minska incidensen av HR + bröstcancer hos högriskpatienter på grund av en minskning av incidensen av CLBC jämfört med tamoxifen i kliniska prövningar som ATAC.6
ai kemopreventionsstudier inkluderar International Breast Cancer Study Group (IBCSG) trial 31-03 (IBCSG 31-03) och National Cancer Institute of Canadas karta.3 rättegång. Det primära målet för multicenter, internationell, randomiserad, placebokontrollerad IBCSG 31-03-studien är att utvärdera användningen av anastrozol för förebyggande av bröstcancer hos postmenopausala kvinnor. Dess primära resultatmått är förekomsten av invasiv och icke-invasiv bröstcancer; det sekundära resultatmåttet är förekomsten av osteoporos och frakturer.5 IBCSG 31-03-försöket har en målregistrering på 6,000 xnumx. karta.3-studien utvärderar exemestan som ett kemopreventivt medel hos postmenopausala kvinnor. Det primära målet för den placebokontrollerade kartan.3 försök är att bedöma effektiviteten av exemestan för att minska förekomsten av invasiv bröstcancer.
potentiella framtida användningsområden: fallrapporter
Letrozol användes efter misslyckande av klomifen för att inducera fertilitet hos 22 kvinnor med polycystiskt äggstockssyndrom. Letrozol inducerade ägglossning i 75% av cyklerna mot 44, 4% av cyklerna inducerade av klomifen. Fyra graviditeter berodde på ägglossningarna inducerade av letrozol, och inga signifikanta biverkningar var associerade med letrozol.28,29
en 57-årig överviktig kvinna med endometrios efter hysterektomi och bilateral salpingo-oophorektomi fick anastrozol efter megestrolbehandling. Patienten hade inga endometriella lesioner efter nio månader.28,30
en patient med McCune-Albrights syndrom fick anastrozol för för tidig pubertet; patientens östradiol normaliserades efter 2,5 års anastrozol och benåldern avancerade med sex månader.28,31 ökat östrogen kan inducera gynekomasti och hypogonadotropisk hypogonadism.28,31 minskande östrogen med en AI resulterade i normal gonadotropin och testosteron hos män med gynekomasti och hypogonadotropisk hypogonadism. 28,31,32
Letrozol studerades hos patienter med recidiverande äggstockscancer; de patienter som fick letrozol hade stabilisering av sjukdomen.28,33 Neoadjuvant letrozol gavs till 10 postmenopausala kvinnor med endometriecancer; läkemedlet visade konstruktiva kliniska förändringar och hade ingen negativ kirurgisk inverkan.28,34
när behandling med testolakton kontra anastrozol jämfördes hos infertila män var effekten av de två medlen liknande.28,35 patienter med Klinefelters syndrom hade effektivare behandling med testolakton än med anastrozol.28,35
slutsatser
tredje generationens AIs har visat överlägsen DFS hos postmenopausala kvinnor med HR+ bröstcancer, men den kliniska fördelen med mer än fem års AI-behandling hos dessa patienter har inte fastställts.4 National Surgical adjuvant Breast and tarm Project (NSABP) B-33 (exemestane) försök och en efterföljande randomisering av MA.17 (letrozol) studie kommer att undersöka användningen av dessa AIs kontra placebo i ytterligare fem år.4 AIs är ett lämpligt alternativ för HR + postmenopausala kvinnor i vilka tamoxifen är kontraindicerat.4
de positiva effekterna av tredje generationens AIs inkluderar en mer tolerabel toxicitetsprofil och överlägsen DFS jämfört med tamoxifen. Effektivitetsnivån mellan dessa medel och tamoxifen är jämförbar. Osäkerheten kvarstår beträffande den valda behandlingstiden, den långsiktiga toxicitetsprofilen och lämplig administreringssekvens för AIs.4 nya studier behövs för att producera selektiva aromatasmodulatorer som ger mindre toxicitet än AIs.25,36 – 37
1. Robertson JFR. Fulvestrant (Faslodex Portuguese)-hur man gör ett bra läkemedel bättre. Onkolog . 2007;12:774-784.
2. Osborne CK. Drogterapi: tamoxifen vid behandling av bröstcancer. N Engl J Med. 1998;339:1609-1618.
3. Nationella Cancer Omfattande Nätverk. NCCN riktlinjer för klinisk praxis inom onkologi-v. 1. 2008. Bröstcancer. www.nccn.org/professionals/physician_gls/f_guidelines.asp. åtkomst 11 oktober 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology Technology bedömning av användningen av aromatashämmare som adjuvant terapi för postmenopausala kvinnor med hormonreceptorpositiv bröstcancer: statusrapport 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Förebyggande av hormonrelaterade cancerformer: bröstcancer. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. aromatashämmare i bröstcancer. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Aromatashämmare vid behandling och förebyggande av bröstcancer. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, Red. Droginformationshandbok. 13: e upplagan. Hudson, Åh: Lexi-Comp; 2005: 117,598,871.
9. Ellis MJ, ed. Aromatashämmare för behandling av bröstcancer. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005:29-45.
10. Arimidex (anastrozol) bipacksedel. Wilmington, DE: AstraZeneca Pharmaceuticals LP; maj 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses = ogst§ion_id=148&visa=avd&article_id=9884. Åtkomst 17 Mars 2008.
14. Aromasin (exemestane) bipacksedel. New York, New York: Pfizer Inc; Februari 2007.
15. Baum M, Budzar AU, Cuzick J, et al, för ATAC Trialists ’ Group. Anastrozol ensamt eller i kombination med tamoxifen kontra tamoxifen ensamt för adjuvant behandling av postmenopausala kvinnor med tidig bröstcancer: första resultaten av den randomiserade ATAC-studien. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, för ATAC Trialists ’ Group. Resultat från ATAC-studien (Arimidex, Tamoxifen, ensam eller i kombination) efter avslutad 5 års adjuvansbehandling för bröstcancer. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. En randomiserad studie av letrozol hos postmenopausala kvinnor efter fem års tamoxifenbehandling för bröstcancer i tidigt stadium. N Engl J Med. 2003;349:1793-1802.
18. Thrimann B, Keshaviah A, Coates AS, et al, för Breast International Group (BIG) 1-98 samarbetsgrupp. En jämförelse mellan letrozol och tamoxifen hos postmenopausala kvinnor med tidig bröstcancer. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, för Intergruppen Exemestane-studien. En randomiserad studie av exemestan efter två till tre års tamoxifenbehandling hos postmenopausala kvinnor med primär bröstcancer. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Ben HG, Chlebowski R, et al. En fas 3-studie av effekten av denosumab-behandling på benmineraltäthet hos kvinnor som får aromatashämmare för icke-metastatisk bröstcancer. Papper presenteras på: den 30: e årliga San Antonio Breast Cancer Symposium; December 13-16, 2007; San Antonio, TX. Sammanfattning 47.
21. Singh S, Cuzick J, Edwards R, et al. Effekt av anastrozol på benmineraltäthet efter ett års behandling: resultat från benunderstudie av International Breast Cancer Intervention Study (IBIS-II). Papper presenteras på: den 30: e årliga San Antonio Breast Cancer Symposium; December 13-16, 2007; San Antonio, TX. Sammanfattning 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. adjuvant endokrin terapi för premenopausala kvinnor med tidig bröstcancer. J Clin Oncol. 2005;23:1736-1750.
23. Nationella Cancerinstitutet. Bröstcancerbehandling (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. åtkomst 26 December 2007.
24. Baylor College of Medicine kliniska prövningar. Undertryckande av Ovariefunktionsförsök (mjuk). www.breastcenter.tmc.edu/clinic/trials/soft.htm. åtkomst 26 December 2007.
25. Aebi S, Castiglione-Gertsch M. adjuvant endokrin terapi för de mycket unga patienterna. Bröst. 2003;12:509-515.
26. ClinicalTrials.gov. undertryckande av äggstocksfunktionen plus antingen tamoxifen eller exemestan jämfört med tamoxifen enbart vid behandling av premenopausala kvinnor med hormonresponsiv bröstcancer. www.clinicaltrials.gov/. åtkomst 26 December 2007.
27. Cuzick J. Aromatashämmare för förebyggande av bröstcancer. J Clin Oncol. 2005;23:1636-1643.
28. Kara O, Oru CU S, Koyuncu FM. Aromatashämmare: möjliga framtida tillämpningar. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Användning av en aromatashämmare för induktion av ägglossning hos patienter med otillräckligt svar på klomifencitrat. Fertil Steril. 2001;75:305-309.
30. Det finns många olika typer av produkter. Roll aromatas i endometrial sjukdom. J Steroid Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Användning av aromatashämmare i tidig pubertet. Endocr Relat Cancer. 1999;6:303-306.
32. Han är en av de mest kända i världen. Östrogenöverskott associerat med nya förstärkningsfunktionsmutationer som påverkar aromatasgenen. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, et al. CA 125-svar är associerat med östrogenreceptoruttryck i en fas II-studie av letrozol i äggstockscancer: identifiering av en endokrin känslig undergrupp. Clin Cancer Res. 2002; 8:2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Neoadjuvant behandling av endometriecancer med aromatashämmaren letrozol: endokrina och kliniska effekter. Euro J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Aromatashämmare för manlig infertilitet. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. aromatas och dess hämmare: betydelse för bröstcancerterapi. Senaste Prog Horm Res. 2002; 57: 317-338.