en bra utgångspunkt för när du måste hitta elektronkonfigurationen för en jon är elektronkonfigurationen för den neutrala atomen.
i ditt fall måste du hitta elektronkonfigurationen för fluoridanjonen, # ” F ”^ ( -)#, så börja med att skriva elektronkonfigurationen för en neutral fluoratom, #”F”#.
Fluor ligger i period 2, Grupp 17 i det periodiska bordet och har ett atomnummer av #9#. Detta säger att den neutrala fluoratomen har totalt# 9 # elektroner som omger dess kärna.
dess elektronkonfiguration kommer att vara
# ” F:”1s^2 2s^2 2p^5#
nu bildas #” F ” ^ ( -)# anjon när #1# elektron läggs till en neutral fluoratom.
Lägg märke till att 2P-subshell av den neutrala atomen innehåller #5# elektroner. Dess maximala kapacitet är faktiskt # 6 # elektroner, två elektroner för varje p-orbital.
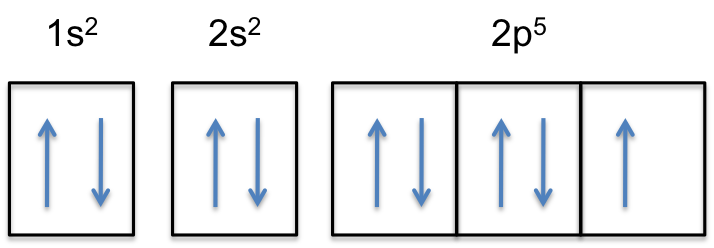
detta betyder att #color(red)(”extra electron”)# kommer att läggas till en av de tre 2P-orbitalerna, låt oss säga till #2p_y#.
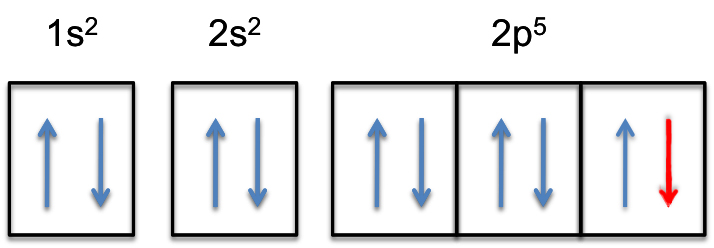
2p-subshell kommer nu att fyllas helt, dvs det kommer att hålla # 6 # elektroner.
elektronkonfigurationen för fluoridanjonen kommer således att vara
#färg(Grön)(|bar (ul(Färg(Vit) (a/A)Färg (Svart) (”F”^( -):Färg(Vit)(A) 1s^2color(vit)(A) 2s^2 Färg(Vit)(a)2p^6)Färg(Vit)(a/a)|))#
Lägg märke till att fluoridanjonen har totalt #8# elektroner i sitt andra skal, det yttersta skalet. Detta säger att anjonen har en komplett oktett.
eftersom fluoridanjonen är isoelektronisk med neon, #”Ne”#, kan du skriva dess elektronkonfiguration med ädelgasens stenografi som
#”F”^(-): #
Här
## – elektronkonfigurationen för neon