Vad är redoxpotentialen för en cell?
Reader Mode
Redoxpotentialer används för att karakterisera den fria energikostnaden och riktningen för reaktioner som involverar elektronöverföring, en av de mest allestädes närvarande och viktiga biokemiska reaktionerna. Sådana reduktionsoxidationsreaktioner kännetecknas av en fri energiförändring som delar vissa konceptuella egenskaper med den som används för att beskriva pKa i syrabasreaktioner där protonöverföring är involverad snarare än elektronöverföring. I denna vinjett, en av de mest abstrakta i boken, diskuterar vi hur redoxpotentialen kan användas som ett mått på drivkraften för en given oxidationsreduceringsreaktion av intresse. Som kontrast, till skillnad från pH, finns det ingen mening i vilken man kan tilldela en enda redoxpotential till en hel cell.
redoxpotentialen, eller mer exakt reduktionspotentialen, för en förening hänvisar till dess tendens att förvärva elektroner och därigenom reduceras. Vissa läsare kanske kommer ihåg den mnemoniska ”OILRIG” som påminner oss om att ”oxidation är förlust, reduktion är vinst”, där förlusten och vinsten är av elektroner. Tänk på en reaktion som involverar en elektronöverföring: AOX + ne– Aci-ared där n-elektroner tas upp av den oxiderade formen (Aox) för att ge den reducerade formen (Ared) av förening A. Redoxpotentialskillnaden mellan ELEKTRONDONATORN och acceptorn är relaterad till den associerade fria energiförändringen av reaktionen via UBIG=NF ubic där n är antalet överförda elektroner och F är Faradays konstant (96 485 J/mol/V eller 100 kJ/mol/v). Genom att inspektera tabellvärden för dessa potentialer är det möjligt att utveckla en intuition för tendensen för elektronöverföring och därmed av reaktionens riktning.

Figur 1: ett” redoxtorn ” som visar redoxpotentialen för vanliga metaboliska halvreaktioner. Metaboliska processer kan ses som rörliga elektroner mellan molekyler, ofta fånga en del av den energi som frigörs när elektronerna rör sig från hög energi till lägre energitillstånd som i glykolys eller andning. Elektroner donerade av” halvreaktionerna ” ovanpå kan konsumeras i en halvreaktion lägre på tornet för att slutföra en termodynamiskt gynnsam reaktion. Till exempel innefattar nettoprocessen av glykolys oxidationen av glukos till pyruvat kopplad till reduktionen av NAD+ till NADH. Eftersom oxidationen av glukos ligger på toppen av tornet och minskningen av NAD+ ligger under den, är detta elektronflöde termodynamiskt gynnsamt. Jämförelse med ATP-hydrolysskalan kan vi också se att detta elektronflöde är tillräckligt gynnsamt för att generera ATP. Aerob andning involverar många mellanliggande elektronöverföringar genom elektrontransportkedjan. Flera av dessa övergångar visas, inklusive oxidationssuccinat till fumarat som är mekaniskt kopplat till reduktionen av ubikinon till ubiquinol i de inre mitochrondrialmembranen. Var och en av dessa mellanliggande elektronöverföringar måste vara termodynamiskt gynnsamma på egen hand för att andningen ska fortsätta. Genom att jämföra med ”ATP-hydrolysskalan” kan vi se att de enskilda transformationerna i elektrontransportkedjan inte är tillräckligt energiska för att generera ATP på egen hand. Ändå är de gynnsamma nog att pumpa en proton över cellen eller mitokondriella membranet. Detta är den energiska grunden för kemiosmos: celler lagrar kvanta energi för liten för ATP-syntes i protongradienten över ett membran. Den energin används senare för att generera ATP genom att omvandla H+ – gradienten till fosfoanhydridbindningar på ATP genom ATP-syntas.
även om ATP ofta hävdas vara cellens energivaluta, är faktiskt för cellens energiska balans bärarna av reducerande kraft själva inte mindre viktiga. Det viktigaste exemplet på dessa bärare är molekylen NADH i dess reducerade eller oxiderade (NAD+) former. Vi kan använda redoxpotentialen för att ansluta dessa två molekylära huvudpersoner och uppskatta en övre gräns på antalet ATP-molekyler som kan produceras från oxidationen av NADH (producerad till exempel i TCA-cykeln). Nad + / NADH-paret har en redoxpotential på E = -0.32 V och det oxideras av syre för att ge vatten (protoner som kommer från media) med en redoxpotential på E = +0.82 V. båda visas i Figur 1 som en del av ett ”redoxtorn” av viktiga biologiska halvreaktioner som kan kopplas för att hitta den totala redoxpotentialförändringen och därmed den fria energin. För reaktionen ovan anses av NADH oxidation med syre, maximal tillhörande fria energi som kan utvinnas är därmed
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
där n=2 och F≈100kJ/mol/V. Som ATP hydrolys har en fri energi förändring av ≈50kJ/mol under fysiologiska förhållanden finner vi att 228 kJ/mol räcker det att producera ett maximalt 228/50≈4.5 ATPs. I cellen fortsätter oxidationen av NADH genom flera steg i andning och resulterar i överföring av 10 protoner över membranet mot den elektrokemiska potentialen (BNID 101773). Dessa protonöverföringar motsvarar ännu ett sätt att fånga biokemisk energi. Denna energi används sedan av ATPase för att producera 2-3 ATP. Vi finner således att ungefär hälften av den energi som släpptes i överföringen av elektroner från NADH till syre bevaras i ATP. Att säkerställa att reaktionen fortskrider på ett riktat sätt för att producera ATP snarare än att konsumera det kräver att en del av energin är ”bortkastad” eftersom systemet måste vara ur jämvikt.
varför ska man diskutera redoxpotentialer av halva reaktioner och inte fria energier av fulla reaktioner? Enheterna själva är skyldiga sitt ursprung till förmågan inom elektrokemi att i labbet mäta spänningsskillnaden, dvs potentialen uppmätt i volt, över två kamrar som innehåller olika elektronbärare, och att stoppa nätreaktionen med en spänning. Användbarheten av redoxpotentialer för halva reaktioner ligger i förmågan att montera kombinationer av olika givare och acceptorer för att bedöma den termodynamiska genomförbarheten och energiförstärkningen för varje betraktad reaktion. Om du har k möjliga elektronöverföringsföreningar kan ~k2 möjliga reaktioner förutsägas baserat på endast k redoxpotentialer.
precis som vi talar om pH i en lösning, kan vi vid första gissningen föreställa oss att det skulle vara möjligt att tala om en uppenbarligen analog redoxpotential i cellen. Att känna till koncentrationen av de reducerade och oxiderade formerna av ett givet reaktionspar definierar deras pool redoxpotential via förhållandet
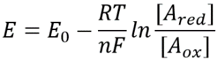
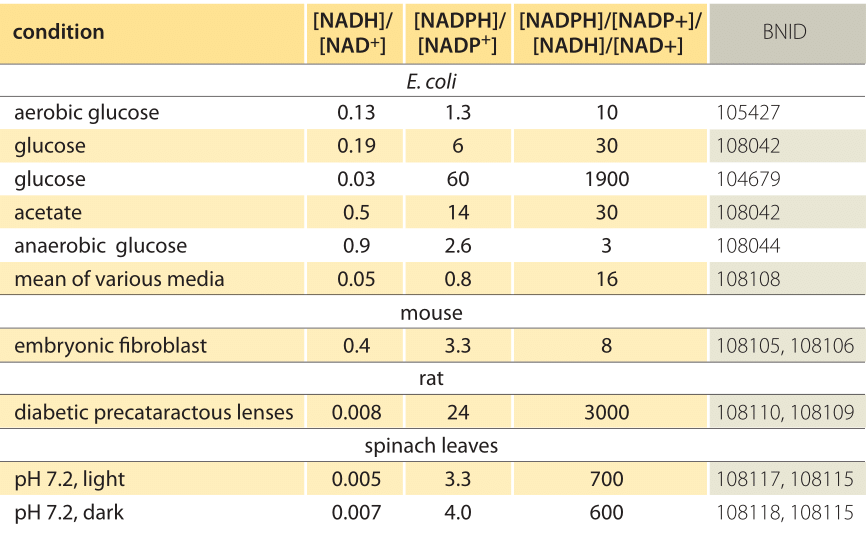
tabell 1: koncentrationsförhållanden för de vanliga elektrondonatorparen NAD/NADH och NADP/NADPH. Som framgår är den första relativt oxiderad och den andra relativt reducerad med ett förhållande mellan dem vanligtvis mycket större än 1.
denna ekvation (en så kallad Nernst-ekvation) ger värdet av redoxpotentialen under koncentrationsbetingelser som är typiska för cellen i motsats till standardtillståndsbetingelserna (där per definition =). Som ett exempel, överväga donationen av en elektron till NAD+ vilket resulterar i den oxiderade formen NADH. I mitokondriematrisen rapporteras ett förhållande på 10 gånger mer av den oxiderade formen (BNID 100779) som visas i Tabell 1. I det här fallet finner vi att faktorn är 30 MV och därmed redoxpotentialen ändras från -0.32 V till -0.29 V. För att säkerställa att effektriktningen vi fick är förnuftig märker vi att med en överflöd av den oxiderade formen är tendensen att oxideras av syre något lägre, vilket framgår av det faktum att redoxpotentialen nu är närmare än tidigare för syre/vattenelektronutbytesparet (+0.82 V).
en cell är inte i jämvikt och det finns svag koppling mellan olika redoxpar. Denna situation leder till upprättandet av olika redoxpotentialer för samexisterande redoxpar i cellen. Om flödena av produktion och utnyttjande av de reducerade och oxiderade formerna av ett redoxpar, Ared och AOX och en annan uppfödd och låda, är mycket större än deras interkonverteringsflöde, ared+Box<>AOX+uppfödda kan A och B ha mycket olika redoxpotentialer. Som ett resultat är det dåligt definierat att fråga om cellens totala redoxpotential eftersom det kommer att vara annorlunda för olika komponenter i cellen. Som kontrast är cellens pH (eller något fack i det) mycket bättre definierat eftersom vatten fungerar som det universella mediet som kopplar ihop de olika syrabasreaktionerna och jämviktar det som kallas kemisk potential för alla arter.
för ett givet redoxpar i ett givet cellfack föreskriver koncentrationsförhållandet för de två formerna redoxpotentialen på ett väldefinierat sätt. Föreningar som utbyter elektroner snabbt kommer att vara i relativ jämvikt och därmed dela en liknande redoxpotential. För att se hur dessa tankar spelar ut är det därför mest användbart att överväga ett redoxpar som deltar i många viktiga cellulära reaktioner och som ett resultat är tätt relaterat till redoxtillståndet hos många föreningar. Glutation i cytoplasman är en sådan förening som den deltar i reduktionen och oxidationen av de mycket vanliga tiolbindningarna (de som innehåller svavel) i cysteinaminosyror av många proteiner. Glutation är en tripeptid (sammansatt av 3 aminosyror), den centrala en cystein som kan vara i en reducerad (GSH) eller oxiderad form där den bildar en dimer med en cystein från en annan glutationmolekyl (betecknad GSSG). Halvreaktionen för glutation är således 2 x GSH <> GSSG + 2e– + 2h+. Den andra halvreaktionen är ofta en svavelbindning som” öppnas ” i ett mottagligt protein och hålls därmed i reducerad form på grund av den konstanta verkan av glutation. Glutation är också en dominerande aktör i neutraliserande reaktiva föreningar som har en hög tendens att rycka elektroner och därmed oxidera andra molekyler. Sådana föreningar tillverkas under oxidativ stress som till exempel när kapaciteten hos elektronöverföringsreaktionerna av andning eller fotosyntes uppnås. Kollektivt kallade ROS (reaktiva syrearter) de kan skapa kaos i cellen och är inblandade i många åldringsprocesser. Glutationens dubbla roll för att hålla proteiner vikta ordentligt och begränsa ROS såväl som dess relativt höga koncentration och elektronöverföringsreaktivitet gör den till den främsta proxy för redoxtillståndet i cellen. Koncentrationen av glutation i cellen är 10 mm (bnid 104679, 104704, 111464), vilket gör den till den näst vanligaste metaboliten i cellen (efter glutamat) som säkerställer att den spelar en dominerande roll som elektrondonator i redoxkontroll av proteinfunktion. I andra funktioner hos celler finns det andra dominerande elektronpar. I biosyntetiska anabola reaktioner NADP + / NADPH-paret och i nedbrytningskataboliska reaktioner är det NAD+/NADH.
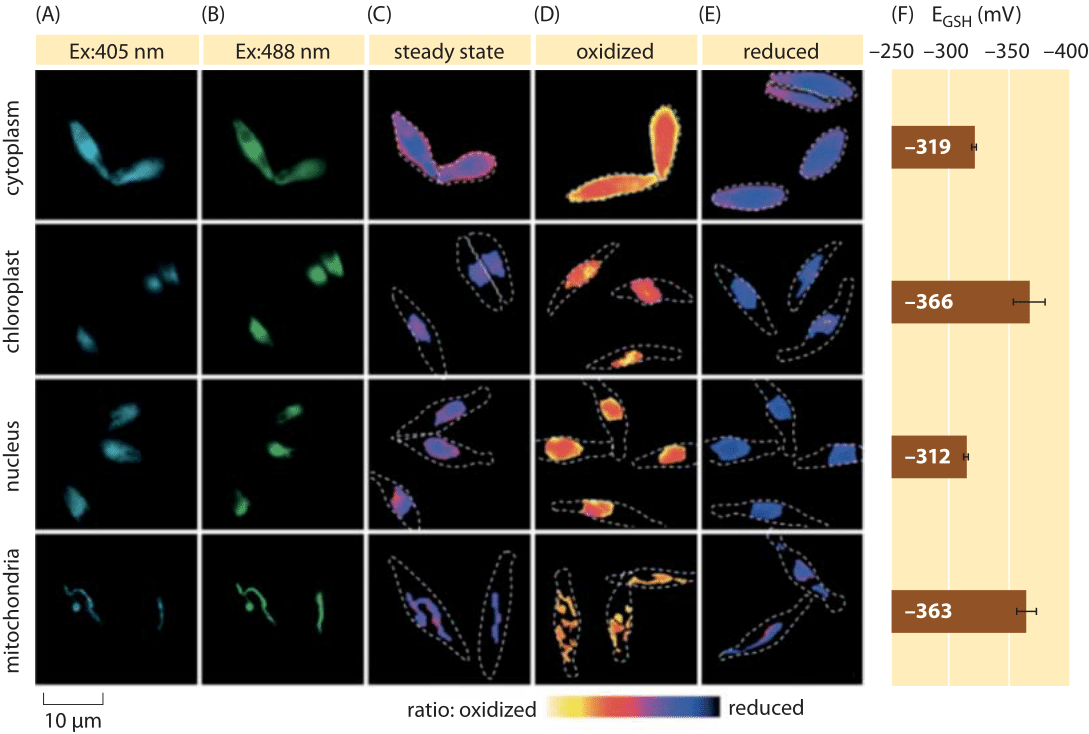
Figur 2: avbildning av subcellulär redoxpotential hos glutationpoolen i kiselalger in vivo. Fluorescensmikroskopi avbildning av P. tricornutumceller som uttrycker roGFP2 i olika subcellulära lokaliseringar. Fluorescensbilder vid två exciteringsvåglängder (A, B) delades upp för att erhålla ratiometriska värden (C). För kalibrering tas ratiometriska bilder under starka oxidationsmedel (150 mM H2O2) (D) och reduktionsmedel (1 mM DTT) (E) förhållanden. Streckade linjer representerar cellernas kontur, ritad baserat på de ljusa fältbilderna. (F) Steady-state redoxpotential för glutationpoolen, EGSH I mV, beräknades baserat på Nernst-ekvationen med användning av oxidationsnivån under givna pH-värden för varje organell. Anpassad från: S. Graff van Creveld et al., ISME J., 9: 385, 2015.
hur går det att mäta redoxpotentialer i levande celler? Ännu en mottagare av den fluorescerande proteinrevolutionen var föremål för redoxpotentialer. En reporter GFP konstruerades för att vara redoxkänslig genom införlivande av cysteinaminosyror som påverkar fluorescensen baserat på deras reduktion av glutationpoolen. Figur 2 visar resultatet av att använda en sådan reporter för att titta på glutation redoxpotentialen i olika fack i en diatom.
från mätningar av redoxtillståndet hos glutationpoolen i olika cellulära organeller och under varierande förhållanden kan vi härleda förhållandet mellan koncentrationerna av de reducerade till oxiderade formerna. Värdena sträcker sig från cirka -170 mV i ER och i apoptotiska celler till cirka -300 mV i de flesta andra organeller och i proliferationsceller (BNID 103543, 101823, 111456, 111465). Med tanke på att standard redoxpotentialen för glutation är -240 mV (BNID 111453, 111463), vad är då förhållandet reducerat till oxiderad glutation? Med hjälp av Nernst-ekvationen (eller motsvarande, från Boltzmann-fördelningen) motsvarar en tiofaldig förändring av produkt/reaktantförhållandet en ökning med 6 kJ/mol i fri energi (2 KBT). Med tanke på de 2 elektroner som överförs i GSH/GSSG-reaktionen är denna förändring av koncentrationsförhållandet vanligtvis lika med 30mv, men för glutation gör stökiometrin av 2 GSH-molekyler som slås samman till en GSSG kovalent bunden molekyl detta bara en approximation. Den 100 mV-förändring som rapporteras över förhållanden återspeglar ett förhållande av koncentrationer mellan ungefär lika stora mängder av de reducerade och oxiderade formerna (i apoptotiska celler) till över 1000 gånger mer koncentration av den reducerade formen. I de flesta cellulära förhållanden är den oxiderade formen bara en mycket liten del av den totala poolen men fortfarande med fysiologiska konsekvenser.
en förvirrande aspekt av redoxreaktioner är att överföringen kan ta flera former. I ett fall är det bara elektroner som i reaktionerna som utförs av cytokromer i elektronöverföringskedjor. I ett annat vanligt fall är det en kombination av elektroner och protoner som i kofaktorn NAD+/NADH där två elektroner och en proton (H+) överförs. Slutligen finns det reaktionerna där samma antal elektroner och protoner överförs när man naturligtvis skulle frestas att diskutera överföring av väten. Detta är till exempel fallet för den totala reaktionen av glukosoxidation där syre reduceras till vatten. Två väten har således överförts, så bör man diskutera överföringen av elektroner, väten eller protoner? Definitionen av redoxpotentialen (ges ovan) fokuserar endast på elektronens ”tillstånd”. Vad sägs om protonerna och vad händer med dessa när man stöter på en kedja av elektronöverföringsreaktioner där vissa mellanliggande föreningar innehåller väteprotonerna och vissa inte? Förklaringen ligger i det omgivande vattnet och deras pH. reaktionen sker vid ett givet pH, och de reagerande föreningarna är i jämvikt med detta pH och därmed avger eller tar emot en proton har ingen effekt på energetiken. Det vattenhaltiga mediet fungerar som en pool där protoner kan ”parkeras” när överföringsreaktionen enbart är av elektroner (analogin lånad från den mycket tillgängliga inledande biokemiboken ”livets kemi” av Steven Rose). Dessa parkerade protoner kan lånas tillbaka i efterföljande steg som inträffar i det sista steget av oxidativ andning där cytokromoxidas tar protoner från mediet. Eftersom man antar att vatten är allestädes närvarande behöver man inte redogöra för protoner förutom att känna till det rådande pH som visar tendensen att ge eller ta emot protoner. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




