Tja, överväga delokalisering av elektrondensitet. Det är när elektrondensiteten sprids så mycket som möjligt genom en molekyl, så att minsta laddningsuppbyggnad är närvarande i en given orbital.
som beskrivs:
- kollektivt av alla resonansbidragsgivare i Lewis-strukturer.
- kollektivt av alla individuella molekylära orbitalbidrag i molekylära orbitaldiagram.
(det finns subtila skillnader mellan dessa, men dessa är ungefär Analoga för enkelhet. Se här för mer detaljer.)
Elektrondensitetslokalisering är bristen på det.
det är när vi fyller all elektrondensitet i några orbitaler, istället för att sprida ut det, och det händer nästan aldrig riktigt i en riktig molekyl eller kvantsystem (även om det inte finns någon resonans pågår).
exempel med resonansstrukturer
Tänk på den isolerade (icke-reagerande) allylkatjonen, #”C”_3″H” _5^(+)#.
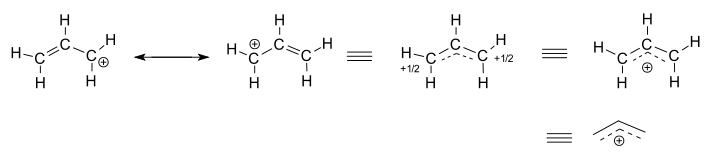
- de vänstra två strukturerna är resonansbidragsgivare, vilka var och en är lokaliserade representationer av den sanna delokaliserade strukturen.
- de tre högra strukturerna är var och en representationer av resonanshybridstrukturen eller den delokaliserade strukturen.
den delokaliserade strukturen beskrivs i grunden av en samling bindningsmolekylära orbitaler.
exempel med ett molekylärt ORBITALDIAGRAM
Tänk på allylkatjonen igen i ett MO-diagram som bara beskriver #bbpi# – elektronerna (dvs elektronerna som skulle vara i en #pi# – bindning i en lokal dubbelbindning!), men tillåter deltagande i reaktioner:
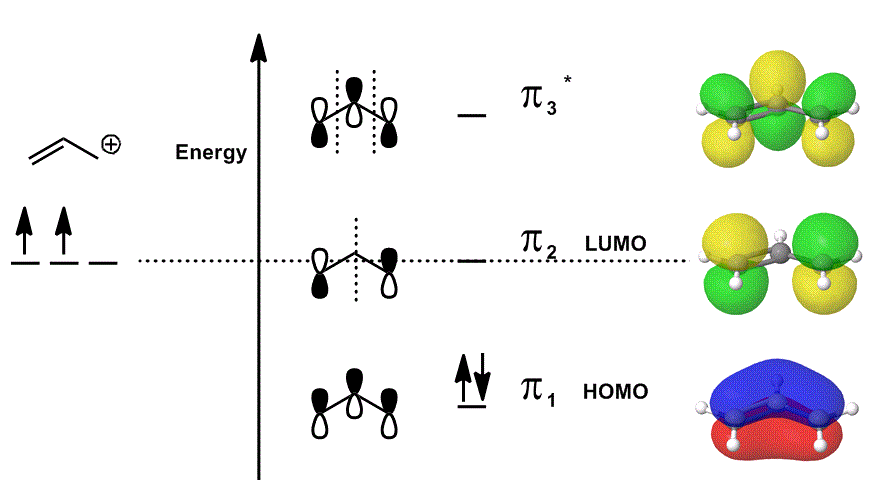
- var och en av orbitalbidragen i mitten avbildas lokaliserade; atomorbitalerna som skulle överlappa visas som sig själva (fas ingår).
- var och en av orbitalerna längst till höger (en per rad) avbildas delokaliserad; elektrondensiteten får spridas ut så att de molekylära orbitalerna avbildas med fullständig övervägande av överlappningar, noder och faser.
När du överlappar #pi_1#, #pi_2# och #pi_3^”* ” # och införlivar det viktade bidraget från dessa tillstånd (viktat enligt koefficienterna #c_i#) får du den linjära kombinationen av molekylära orbitaler:
#Psi_(”allyl”^(+)) = c_1overbrace(pi_1)^”bonding” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
och #Psi_(”allyl”^(+))# then beskriver den totala fördelningen av stater som kollektivt beskriver allylkatjonens reaktivitet.
med andra ord, #pi_1# (som donerar #pi# elektroner att binda), #pi_2# (som accepterar elektroner att binda) och #pi_3^”* ” # (i det här fallet kommer det sällan att delta) alla gör något när allylkatjonen deltar i en kemisk reaktion, för (om de är upptagna) finns de samtidigt.