hvad er en celles potentiale?
Læsertilstand bruges til at karakterisere de frie energikostnader og retningen af reaktioner, der involverer elektronoverførsel, en af de mest allestedsnærværende og vigtige biokemiske reaktioner. Sådanne reduktions-iltningsreaktioner er kendetegnet ved en fri energiændring, der deler nogle konceptuelle træk med det, der bruges til at beskrive pKa i syre-basereaktioner, hvor protonoverførsel er involveret snarere end elektronoverførsel. I denne vignet, en af de mest abstrakte i bogen, diskuterer vi, hvordan redokspotentialet kan bruges som et mål for drivkraften for en given iltningsreduktionsreaktion af interesse. Som kontrast er der i modsætning til pH ingen mening, hvor man kan tildele et enkelt redokspotentiale til en hel celle.
redokspotentialet eller mere præcist reduktionspotentialet for en forbindelse henviser til dens tendens til at erhverve elektroner og derved reduceres. Nogle læsere kan huske den mnemoniske “OILRIG”, som minder os om, at” iltning er tab, reduktion er gevinst”, hvor tabet og gevinsten er af elektroner. Overvej en reaktion, der involverer en elektronoverførsel: Aoks + ne-kurr Ared hvor n elektroner optages af den iltede form (Aoks) for at give den reducerede form (Ared) af forbindelse A. Den potentielle forskel mellem elektrondonoren og acceptoren er relateret til den tilknyttede frie energiændring, som reaktionen via larg=NF, hvor n er antallet af overførte elektroner, og F er Faradays konstant (96.485 J/mol/V eller larg 100 kJ/mol/V). Ved at inspicere tabulerede værdier af disse potentialer er det muligt at udvikle en intuition for tendensen til elektronoverførsel og dermed af reaktionens retning.

Figur 1: Et “redokstårn”, der viser redokspotentialet for almindelige metaboliske halvreaktioner. Metaboliske processer kan ses som bevægelige elektroner mellem molekyler, der ofte fanger noget af den frigjorte energi, når elektronerne bevæger sig fra høj energi til lavere energitilstande som ved glykolyse eller respiration. Elektroner doneret af” halvreaktionerne ” på toppen kan forbruges i en halvreaktion lavere på tårnet for at fuldføre en termodynamisk gunstig reaktion. For eksempel involverer nettoprocessen af glykolyse iltning af glukose til pyruvat koblet til reduktion af NAD+ til NADH. Da iltningen af glukose ligger øverst i tårnet, og reduktionen af NAD+ er under den, er denne elektronstrøm termodynamisk gunstig. Sammenlignet med ATP hydrolyse skala bar kan vi også se, at denne elektronstrøm er gunstig nok til at generere ATP. Aerob respiration involverer mange mellemliggende elektronoverførsler gennem elektrontransportkæden. Flere af disse overgange er vist, herunder oksidationssuccinat til fumarat, som er mekanisk koblet til reduktion af allestedsnærværende til allestedsnærværende i de indre mitokrondriale membraner. Hver af disse mellemliggende elektronoverførsler skal være termodynamisk gunstige alene for at respirationen kan fortsætte. Ved at sammenligne med “ATP hydrolyse scale” kan vi se, at de individuelle transformationer i elektrontransportkæden ikke er energiske nok til at generere ATP alene. Alligevel er de gunstige nok til at pumpe en proton over cellen eller mitokondriemembranen. Dette er det energiske grundlag for kemiosmose: celler opbevarer kvanta af energi for lille til ATP-syntese i protongradienten over en membran. Denne energi bruges senere til at generere ATP ved at konvertere h+ – gradienten til phosphoanhydridbindinger på ATP gennem ATP-syntasen.
selvom ATP ofte hævdes at være cellens energivaluta, er det faktisk for den energiske balance i cellen, at bærerne af reducerende effekt selv ikke er mindre vigtige. Det vigtigste eksempel på disse bærere er molekylet NADH i dets reducerede eller iltede (NAD+) former. Vi kan bruge redokspotentialet til at forbinde disse to molekylære hovedpersoner og estimere en øvre grænse for antallet af ATP-molekyler, der kan produceres ved oksidering af NADH (produceret for eksempel i TCA-cyklussen). Nad + / NADH-parret har et rødokspotentiale på E = -0,32 V, og det iltes af ilt for at give vand (protoner, der kommer fra medierne) med et rødokspotentiale på E = +0,82 V. begge er vist i Figur 1 som en del af et “rødokstårn” af vigtige biologiske halvreaktioner, der kan knyttes til at finde den samlede ændring af rødokspotentialet og dermed den frie energi. For den reaktion, der er beskrevet ovenfor, oxidation af NADH af ilt, den maksimale tilhørende gratis energi, der kan udvindes, er således
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
hvor n=2 og F≈100kJ/mol/V. Som ATP-hydrolyse er en gratis energi ændring af ≈50kJ/mol under fysiologiske betingelser, finder vi, at 228 kJ/mol er tilstrækkeligt til at producere et maksimum af 228/50≈4.5 Ahp. I cellen fortsætter iltning af NADH gennem flere trin i respiration og resulterer i overførsel af 10 protoner over membranen mod det elektrokemiske potentiale (BNID 101773). Disse protonoverførsler svarer til endnu en måde at fange biokemisk energi på. Denne energi bruges derefter af ATPase til at producere 2-3 ATPs. Vi finder således, at omkring halvdelen af den energi, der blev frigivet i overførslen af elektroner fra NADH til ilt, bevares i ATP. At sikre, at reaktionen forløber retningsbestemt for at producere ATP i stedet for at forbruge det, kræver, at noget af energien “spildes”, da systemet skal være ude af ligevægt.
hvorfor skal man diskutere redoks potentialer af halv reaktioner og ikke frie energier af fulde reaktioner? Enhederne skylder selv deres oprindelse til evnen inden for elektrokemi til at måle spændingsforskellen i laboratoriet, dvs.potentialet målt i volt, på tværs af to kamre, der indeholder forskellige elektronbærere, og at stoppe nettreaktionen med en spænding. Nytten af redokspotentialer for halve reaktioner ligger i evnen til at samle kombinationer af forskellige donorer og acceptorer for at vurdere den termodynamiske gennemførlighed og energiforøgelse af enhver overvejet reaktion. Hvis du har k mulige elektronoverførselsforbindelser, kan de ~k2 mulige reaktioner forudsiges baseret på kun k-redokspotentialerne.
ligesom vi taler om pH af en opløsning, ved første gæt, kan vi forestille os, at det ville være muligt at tale om et tilsyneladende analogt redokspotentiale i cellen. At kende koncentrationen af de reducerede og iltede former for et givet reaktionspar definerer deres poolredoksepotentiale via forholdet
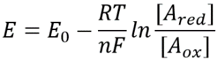
tabel 1: koncentrationsforhold for de fælles elektrondonorpar NAD/NADH og NADP/NADPH. Som det kan ses, er den første relativt iltet, og den anden relativt reduceret med et forhold mellem dem normalt meget større end 1.
denne ligning (en såkaldt Nernst-ligning) tilvejebringer værdien af redokspotentialet under koncentrationsbetingelser, der er typiske for cellen i modsætning til standardtilstandsbetingelserne (hvor PR. Som et eksempel kan du overveje donationen af en elektron til NAD+, hvilket resulterer i den iltede form NADH. I mitokondriematricen rapporteres et forhold på 10 gange mere af den iltede form (BNID 100779) som vist i tabel 1. I dette tilfælde finder vi, at faktoren er 30 mV, og dermed ændres potentialet fra -0.32 V til -0.29 V. For at sikre, at den effektretning, vi fik, er fornuftig, bemærker vi, at med en overvægt af den iltede form er tendensen til at blive iltet af ilt noget lavere, som det ses af det faktum, at redokspotentialet nu er tættere end før på ilt/vand elektronudvekslingspar (+0,82 v).
en celle er ikke i ligevægt, og der er svag kobling mellem forskellige redokspar. Denne situation fører til etablering af forskellige redokspotentialer for sameksisterende redokspar i cellen. Hvis strømmen af produktion og udnyttelse af de reducerede og iltede former for et redokspar, Ared og Aoks og en anden avlet og kasse, er meget større end deres interkonverteringsstrøm, Ared+boks<>Aoks+avlet, kan A og B have meget forskellige redokspotentialer. Som et resultat er det dårligt defineret at spørge om det samlede potentiale i cellen, da det vil være forskelligt for forskellige komponenter i cellen. Som kontrast er pH i cellen (eller i et eller andet rum i den) meget bedre defineret, da vand tjener som det universelle medium, der parrer de forskellige syre-basereaktioner og ækvilibrerer det, der er kendt som det kemiske potentiale for alle arter.
for et givet omkokspar i et givet cellerum foreskriver koncentrationsforholdet mellem de to former omkokspotentialet på en veldefineret måde. Forbindelser, der hurtigt udveksler elektroner, vil være i relativ ligevægt og således dele et lignende omkokspotentiale. For at se, hvordan disse ideer spiller ud, er det således mest nyttigt at overveje et redoks-par, der deltager i mange vigtige cellulære reaktioner og som et resultat er tæt relateret til redoks-tilstanden for mange forbindelser. Glutathion i cytoplasmaet er en sådan forbindelse, da den deltager i reduktion og iltning af de meget udbredte thiolbindinger (dem, der indeholder svovl) i cysteinaminosyrer af mange proteiner. Glutathion er et tripeptid (sammensat af 3 aminosyrer), den centrale en cystein som kan være i en reduceret (GSH) eller iltet form, hvor den danner en dimer med en cystein fra et andet glutathionmolekyle (betegnet GSSG). Halvreaktionen for glutathion er således 2 GSH <> GSSG + 2e– + 2h+. Den anden halvdel reaktion er ofte en svovlbinding, der er” åbnet op ” i en modtagelig protein således holdes i reduceret form på grund af den konstante virkning af glutathion. Glutathion er også en dominerende aktør i neutralisering af reaktive forbindelser, der har en høj tendens til at snappe elektroner og dermed iltne andre molekyler. Sådanne forbindelser fremstilles under oksidativ stress som for eksempel når kapaciteten af elektronoverførselsreaktionerne af respiration eller fotosyntese er nået. Kollektivt kaldet ROS (reaktive iltarter) de kan skabe kaos i cellen og er impliceret i mange aldringsprocesser. Glutathions dobbelte rolle i at holde proteiner foldet korrekt og begrænsende ROS såvel som dets relativt høje koncentration og elektronoverførselsreaktivitet gør det til den primære fuldmagt for cellens røde tilstand. Koncentrationen af glutathion i cellen er 10 mm (BNID 104679, 104704, 111464), hvilket gør den til den næstmest forekommende metabolit i cellen (efter glutamat), hvilket sikrer, at den spiller en dominerende rolle som en elektrondonor i kontrol af proteinfunktionen. I andre funktioner af celler er der andre dominerende elektronpar. I biosyntetiske anabolske reaktioner NADP + / NADPH par og i opdeling kataboliske reaktioner er det NAD+ / NADH.
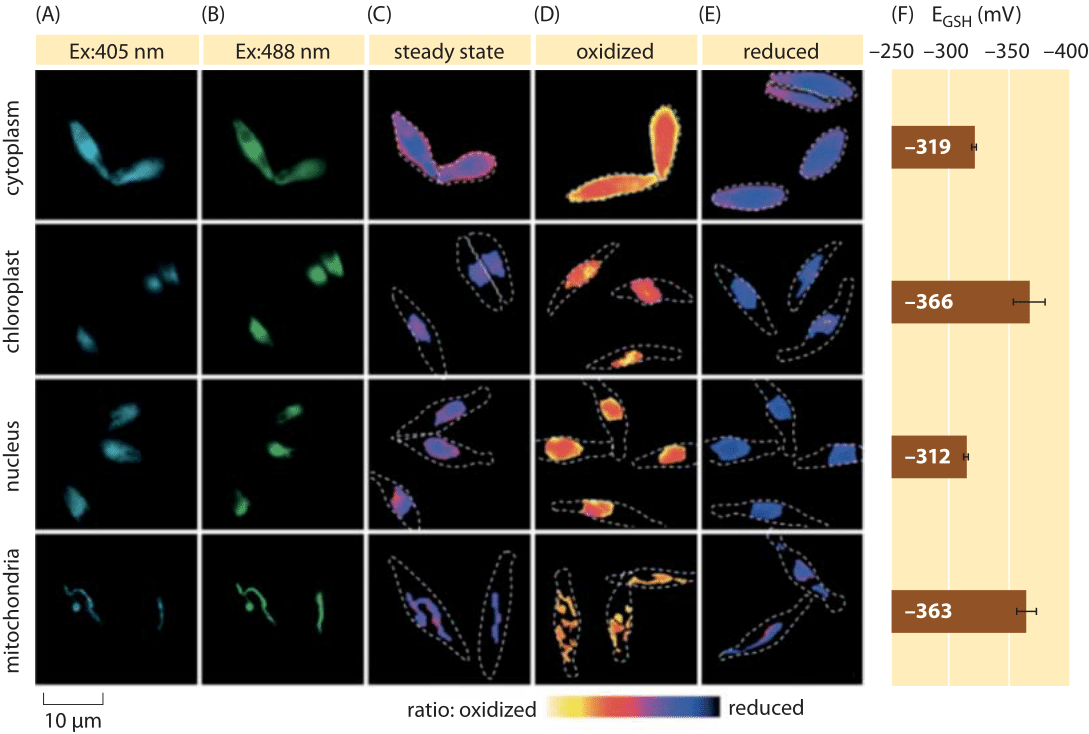
figur 2: billeddannelse af subcellulært redokspotentiale i glutathionpuljen i diatomalger in vivo. Fluorescensmikroskopi billeddannelse af P. tricornutumceller, der udtrykker roGFP2 i forskellige subcellulære lokaliseringer. Fluorescensbilleder ved to eksitationsbølgelængder (A, B) blev opdelt for at opnå ratiometriske værdier (C). Til kalibrering optages ratiometriske billeder under stærkt iltningsmiddel (150 mM H2O2) (D) og reduktionsmiddel (1 mM DTT) (E) betingelser. Stiplede linjer repræsenterer cellernes kontur, tegnet baseret på de lyse feltbilleder. (F) Steady-state redokspotentiale i glutathionpuljen, EGSH i mV, blev beregnet ud fra Nernst-ligningen ved anvendelse af iltningsniveauet under givne pH-værdier for hver organel. Tilpasset fra: S. Graff van Creveld et al., ISME J., 9:385, 2015.
hvordan måler man redokspotentialer i levende celler? Endnu en modtager af den fluorescerende proteinrevolution var genstand for røde potentialer. En reporter GFP blev konstrueret til at være følsom ved inkorporering af cysteinaminosyrer, der påvirker fluorescensen baseret på deres reduktion af glutathionpuljen. Figur 2 viser resultatet af at bruge en sådan reporter til at se på glutathionredoksepotentialet i forskellige rum i et diatom.
fra målinger af glutathionpuljens tilstand i forskellige cellulære organeller og under forskellige forhold kan vi udlede forholdet mellem koncentrationer af de reducerede til iltede former. Værdier spænder fra ca. -170 mV I ER og i apoptotiske celler til ca.-300 mV i de fleste andre organeller og i proliferationsceller (BNID 103543, 101823, 111456, 111465). I betragtning af at glutathions standardredokspotentiale er -240 mV (BNID 111453, 111463), hvad er så forholdet mellem reduceret til iltet glutathion? Ved hjælp af Nernst-ligningen (eller tilsvarende fra boltsmann-fordelingen) svarer en ti gange ændring i forholdet mellem produkt og reaktant til en stigning på 6 kJ/mol i fri energi (2 kBT). I betragtning af de 2 elektroner, der overføres i GSH/GSSG-reaktionen, er denne ændring i koncentrationsforholdet normalt lig med 30mv, dog for glutathion, støkiometrien af 2 GSH-molekyler, der smelter sammen til et GSSG-kovalent bundet molekyle, gør dette kun til en tilnærmelse. Den 100 mV-ændring, der rapporteres på tværs af betingelser, afspejler et forhold mellem koncentrationer mellem omtrent lige store mængder af de reducerede og iltede former (i apoptotiske celler) til over 1.000 gange mere koncentration af den reducerede form. Faktisk i de fleste cellulære forhold er den iltede form kun en meget lille brøkdel af den samlede pool, men stadig med fysiologiske implikationer.
et forvirrende aspekt af redoks reaktioner er, at overførslen kan tage flere former. I et tilfælde er det kun elektroner som i reaktionerne udført af cytokromer i elektronoverførselskæder. I et andet almindeligt tilfælde er det en kombination af elektroner og protoner som i cofaktor NAD+/NADH hvor to elektroner og en proton (H+) overføres. Endelig er der reaktionerne, hvor det samme antal elektroner og protoner overføres, når man naturligvis ville blive fristet til at diskutere overførsel af hydrogener. Dette er for eksempel tilfældet for den samlede reaktion af glucoseoksidering, hvor ilt reduceres til vand. To hydrogener er således blevet overført, så skal man diskutere overførslen af elektroner, hydrogener eller protoner? Definitionen af redokspotentialet (givet ovenfor) fokuserer kun på elektronen “tilstand”. Hvad med protonerne, og hvad sker der med disse, når man støder på en kæde af elektronoverførselsreaktioner, hvor nogle mellemliggende forbindelser indeholder brintprotonerne, og nogle ikke? Forklaringen ligger i det omgivende vand og deres pH. reaktionen sker ved en given pH, og de reagerende forbindelser er i ligevægt med denne pH, og dermed afgiver eller modtager en proton ingen effekt på energien. Det vandige medium fungerer som en pool, hvor protoner kan “parkeres”, når overførselsreaktionen udelukkende er af elektroner (analogien lånt fra den meget tilgængelige indledende biokemibog “the chemistry of life” af Steven Rose). Disse parkerede protoner kan lånes tilbage i efterfølgende faser, som det sker i den sidste fase af iltningsånding, hvor cytokrom oksidase tager protoner fra mediet. Fordi man antager, at vand er allestedsnærværende, behøver man ikke at redegøre for protoner bortset fra at kende den fremherskende pH, der viser tendensen til at give eller modtage protoner. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




