Heizkurven
Abbildung \(\pageIndex{3}\) zeigt eine Heizkurve, ein Diagramm der Temperatur gegen die Heizzeit, für eine 75 g Probe von Wasser. Die Probe ist zunächst Eis bei 1 atm und -23 ° C; Wenn Wärme hinzugefügt wird, steigt die Temperatur des Eises linear mit der Zeit an. Die Steigung der Linie hängt sowohl von der Masse des Eises als auch von der spezifischen Wärme (Cs) des Eises ab, dh der Anzahl der Joule, die erforderlich sind, um die Temperatur von 1 g Eis um 1 ° C zu erhöhen. Mit zunehmender Temperatur des Eises nehmen die Wassermoleküle im Eiskristall immer mehr Energie auf und schwingen kräftiger. Am Schmelzpunkt haben sie genug kinetische Energie, um Anziehungskräfte zu überwinden und sich zueinander zu bewegen. Wenn mehr Wärme hinzugefügt wird, steigt die Temperatur des Systems nicht weiter an, sondern bleibt konstant bei 0 ° C, bis das gesamte Eis geschmolzen ist. Sobald das gesamte Eis in flüssiges Wasser umgewandelt wurde, beginnt die Temperatur des Wassers wieder zu steigen. Jetzt steigt die Temperatur jedoch langsamer an als zuvor, da die spezifische Wärmekapazität von Wasser größer ist als die von Eis. Wenn die Temperatur des Wassers 100 ° C erreicht, beginnt das Wasser zu kochen. Auch hier bleibt die Temperatur konstant bei 100°C, bis das gesamte Wasser in Dampf umgewandelt ist. Zu diesem Zeitpunkt beginnt die Temperatur wieder zu steigen, jedoch schneller als in den anderen Phasen, da die Wärmekapazität von Dampf geringer ist als die von Eis oder Wasser.
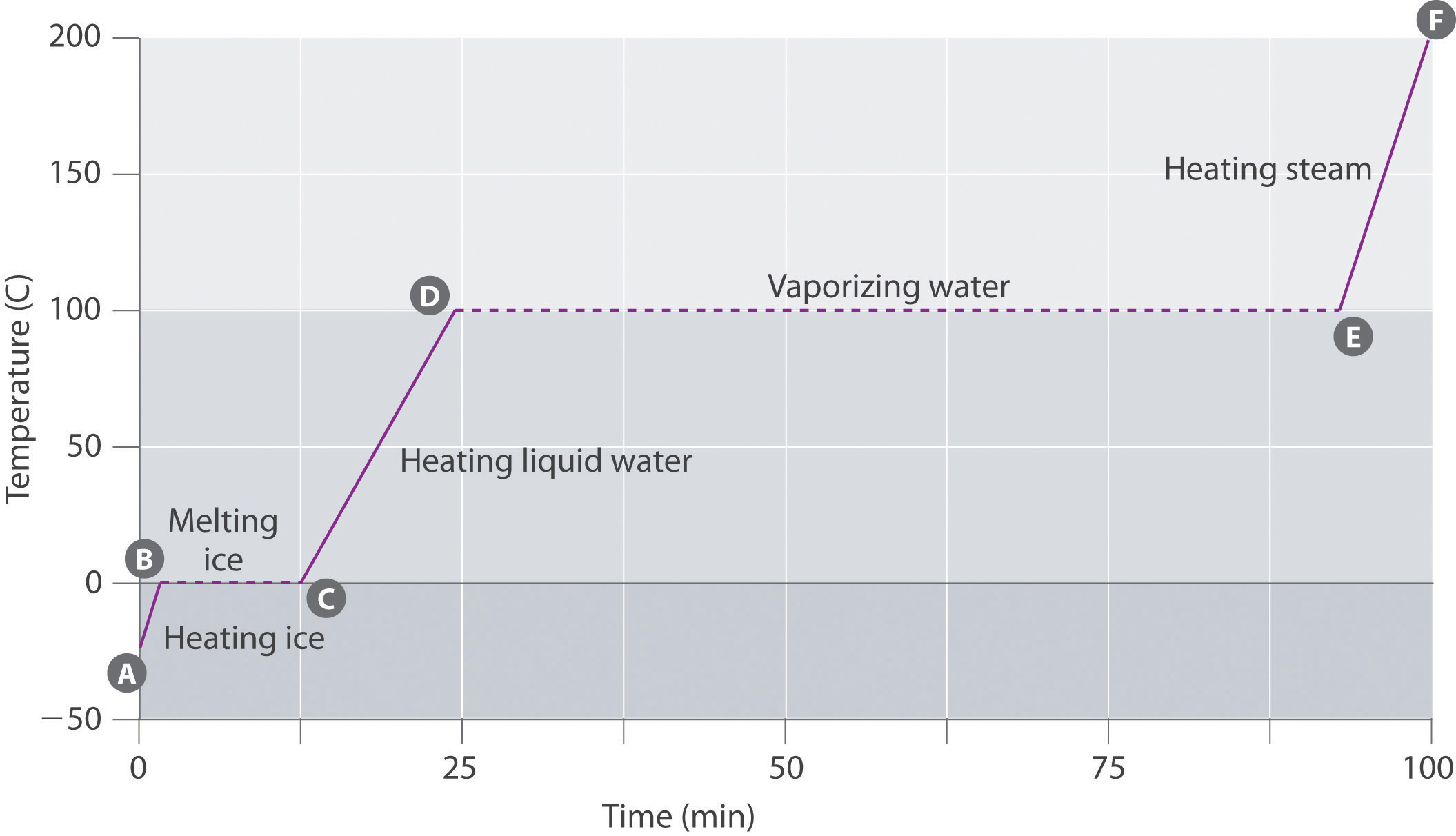
Somit ändert sich die Temperatur eines Systems während eines Phasenwechsels nicht. In diesem Beispiel bleibt die Temperatur des Systems während des Schmelzprozesses bei 0 °C, solange auch nur eine kleine Menge Eis vorhanden ist, und solange auch nur eine kleine Menge flüssiges Wasser vorhanden ist, bleibt die Temperatur des Systems während des Siedeprozesses bei 100 °C. Die Geschwindigkeit, mit der Wärme zugegeben wird, hat keinen Einfluss auf die Temperatur des Eis / Wasser- oder Wasser / Dampf-Gemisches, da die zugegebene Wärme ausschließlich zur Überwindung der Anziehungskräfte verwendet wird, die die kondensierte Phase zusammenhalten. Viele Köche denken, dass das Essen schneller kocht, wenn die Hitze höher gedreht wird, so dass das Wasser schneller kocht. Stattdessen kocht der Topf mit Wasser früher zur Trockenheit, aber die Temperatur des Wassers hängt nicht davon ab, wie stark es kocht.
Die Temperatur einer Probe ändert sich während eines Phasenwechsels nicht.
Wenn Wärme mit einer konstanten Rate hinzugefügt wird, wie in Abbildung \(\pageIndex{3}\), dann ist die Länge der horizontalen Linien, die die Zeit darstellt, während der sich die Temperatur nicht ändert, direkt proportional zur Größe der Enthalpien, die mit den Phasenänderungen verbunden sind. In Abbildung \(\pageIndex{3}\) ist die horizontale Linie bei 100 ° C viel länger als die Linie bei 0 ° C, da die Verdampfungsenthalpie von Wasser um ein Vielfaches größer ist als die Fusionsenthalpie.Eine überhitzte Flüssigkeit ist eine Probe einer Flüssigkeit bei der Temperatur und dem Druck, bei der es sich um ein Gas handeln sollte. Überhitzte Flüssigkeiten sind nicht stabil; Die Flüssigkeit kocht schließlich, manchmal heftig. Das Phänomen der Überhitzung verursacht „Stoßen“, wenn eine Flüssigkeit im Labor erhitzt wird. Wird beispielsweise ein Reagenzglas mit Wasser über einen Bunsenbrenner erhitzt, kann ein Teil der Flüssigkeit leicht zu heiß werden. Wenn sich die überhitzte Flüssigkeit in ein Gas umwandelt, kann sie den Rest der Flüssigkeit aus dem Reagenzglas drücken oder „stoßen“. Wenn Sie einen Rührstab oder ein kleines Stück Keramik (einen „kochenden Chip“) in das Reagenzglas geben, können sich Dampfblasen auf der Oberfläche des Objekts bilden, sodass die Flüssigkeit kocht, anstatt überhitzt zu werden. Überhitzung ist der Grund, warum eine Flüssigkeit, die in einem glatten Becher in einem Mikrowellenofen erhitzt wird, nicht kochen kann, bis der Becher bewegt wird, wenn die Bewegung des Bechers die Bildung von Blasen zulässt.