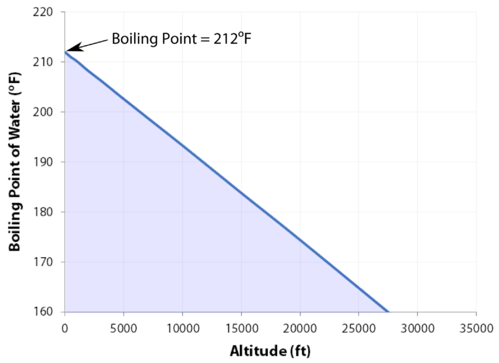
Siedepunkt
Wenn eine Flüssigkeit erhitzt wird, nimmt die durchschnittliche kinetische Energie ihrer Partikel zu. Die Verdampfungsrate nimmt zu, da immer mehr Moleküle der Flüssigkeitsoberfläche in die Dampfphase entweichen können. Schließlich wird ein Punkt erreicht, an dem die Moleküle in der gesamten Flüssigkeit genügend kinetische Energie haben, um zu verdampfen. An diesem Punkt beginnt die Flüssigkeit zu kochen. Der Siedepunkt ist die Temperatur, bei der der Dampfdruck einer Flüssigkeit gleich dem Außendruck ist. Die folgende Abbildung zeigt das Kochen von Flüssigkeit.
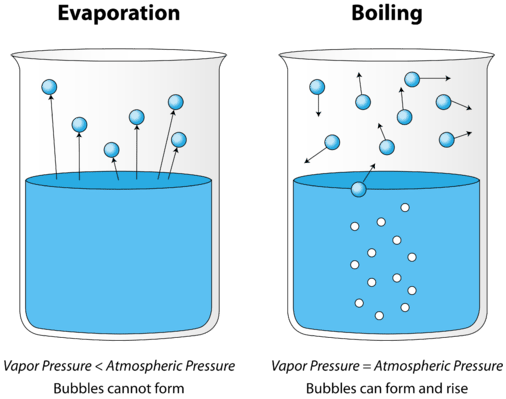
Im Bild links befindet sich die Flüssigkeit unterhalb ihres Siedepunktes, dennoch verdampft ein Teil der Flüssigkeit. Rechts wurde die Temperatur erhöht, bis sich im Flüssigkeitskörper Blasen bilden. Wenn der Dampfdruck in der Blase gleich dem äußeren Atmosphärendruck ist, steigen die Blasen an die Oberfläche der Flüssigkeit und platzen. Die Temperatur, bei der dieser Prozess stattfindet, ist der Siedepunkt der Flüssigkeit.
Der normale Siedepunkt ist die Temperatur, bei der der Dampfdruck der Flüssigkeit dem Standarddruck entspricht. Da sich der atmosphärische Druck je nach Standort ändern kann, ändert sich der Siedepunkt einer Flüssigkeit mit dem Außendruck. Der normale Siedepunkt ist eine Konstante, da er relativ zum Standardatmosphärendruck von \ (760 \: \ text {mm} \: \ce {Hg}\) (oder \ (1 \: \text{atm}\) oder \ (101,3 \: \text{kPa}\)) definiert ist.