Bei Redoxreaktionen geht es darum, Elektronen von einer Substanz auf eine andere zu übertragen. Daher ist es nützlich, ein System zu haben, mit dem verfolgt werden kann, was Elektronen gewinnt und was verliert und wie viele Elektronen beteiligt sind. Das Aufzeichnungssystem für Redoxreaktionen wird Oxidationszahlen genannt. Sie können sich auch an etwas erinnern, das Elektronegativität aus früheren Chemieunterricht genannt wird.
Elektronegativität
Die Fähigkeit eines gebundenen Atoms, gemeinsame Elektronen zu sich selbst anzuziehen.
Wenn zwei Atome verschiedener Elemente durch eine kovalente Bindung miteinander verbunden sind (Elektronen teilen), werden die Elektronen aufgrund unterschiedlicher Elektronegativitäten im Allgemeinen nicht gleichmäßig zwischen den beiden Atomen geteilt. Betrachten Sie dies als Tauziehen um Elektronen. Manchmal ziehen beide Atome mit gleicher Stärke an gemeinsamen Elektronen; Zu anderen Zeiten gibt es eindeutig einen stärkeren Spieler, der die Elektronen näher an sich zieht.
Betrachten Sie die Bindung zwischen einem Wasserstoffatom (mit einem Valenzelektron) und einem Sauerstoffatom (mit seinen sechs Valenzelektronen):
|
|
+
|
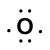 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to Wasserstoffatom. Dies ist nicht die vollständige Übertragung von Elektronen, die ein Ion erzeugen würde, aber es bilden sich Teilladungen. Das Wasserstoffende der Bindung ist teilweise positiv (+1), weil es teilweise ein Elektron verloren hat, und das Sauerstoffende des H-O ist teilweise negativ (-1), weil es teilweise das eine Elektron aus Wasserstoff gewonnen hat:
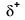 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
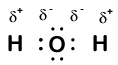
Wir sehen, dass jedes der beiden Wasserstoffatome ein Elektron an Sauerstoff „verloren“ hat. Sauerstoff hat zwei Elektronen „gewonnen“ – eines von jedem Wasserstoff. Auch dies sind keine wahren Ionen, aber es ist nützlich, sie auf die gleiche Weise zu betrachten.
Ladungen, die Atomen in einem Molekül auf diese Weise gegeben werden, werden Oxidationszahlen genannt. Wir können Oxidationszahlen verwenden, um zu verfolgen, wo sich Elektronen in einem Molekül befinden und wie sie sich während einer Reaktion bewegen. In unserem Wasserbeispiel wird Wasserstoff eine Oxidationszahl von +1 zugewiesen, weil jeder einzelne Wasserstoff ein Elektron „verloren“ hat. Sauerstoff hat eine Oxidationszahl von +2, da das einzelne Sauerstoffatom insgesamt zwei Elektronen „gewonnen“ hat, eines von jedem Wasserstoff.
Hier ist ein weiteres Molekül mit Wasserstoff und Sauerstoff – Wasserstoffperoxid, H2O2:
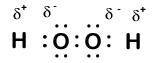
In Wasserstoffperoxid hat jeder Wasserstoff immer noch eine Oxidationszahl von +1, da jeder Wasserstoff ein einzelnes Elektron an Sauerstoff „abgibt“. Sauerstoff hat jetzt jedoch eine Oxidationszahl von -1, da jeder Sauerstoff nur ein Elektron aus seinem benachbarten Wasserstoff gewinnt. Die Elektronen zwischen den beiden identischen Sauerstoffatomen werden gleichmäßig geteilt, so dass sich aus dieser Bindung keine Teilladung ergibt.
Oxidationszahl
Eine positive oder negative Zahl, die einem Atom in einem Molekül oder Ion zugeordnet ist, das einen teilweisen Gewinn oder Verlust von Elektronen widerspiegelt.
Die Kenntnis der Oxidationszahl jedes einzelnen Elements in einem Molekül wird ein wichtiger Schritt für unser Verständnis von Redoxreaktionen sein. Glücklicherweise werden normalerweise keine Elektronenpunktdiagramme gezeichnet. Stattdessen gibt es eine Reihe von Regeln, mit denen wir Oxidationszahlen bestimmen können. Hier sind die Hauptregeln:
| Die Oxidationszahl eines reinen Elements (an sich und nicht eines Ions) ist Null. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal zu seiner Ladung. Alkalimetalle — Elemente in der ersten Spalte des Periodensystems — haben immer eine Oxidationszahl von +1; Erdalkalimetalle (Spalte 2) sind fast immer +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Die Oxidationszahl von Sauerstoff ist fast immer -2, wenn es in einer Verbindung ist. Die Ausnahmen:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Die Summe der Oxidationszahlen in einer Verbindung ist Null. Um die Oxidationszahl von Mn in Mn2O7 zu bestimmen, müssen wir rückwärts arbeiten:
-2 × 7 Atome = -14 gesamt Da die Summe der Oxidationszahlen Null sein muss, muss die Gesamtoxidationszahl von Mn +14 sein, um Sauerstoff -14 aufzuheben, aber da es 2 Mn-Atome gibt, hat jedes einzelne Atom eine Oxidationszahl von +7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Die Summe der Oxidationszahlen in einem mehratomigen Ion ist gleich der Ladung dieses Ions. Arbeiten Sie erneut rückwärts, um die Oxidationszahl eines beliebigen Nicht-Sauerstoff- oder Nicht-Wasserstoffatoms zu bestimmen. Um die Oxidationszahl von Cr in Cr2O72 zu bestimmen- :
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is es ist wichtig zu beachten, dass sich die Oxidationszahl immer auf jedes einzelne Atom in der Verbindung bezieht, nicht auf die Summe für dieses Element.
Zum Beispiel ist in H2O die gesamte positive „Ladung“ für beide Wasserstoffatome +2 (was sich mit dem -2 von Sauerstoff ausgleicht), aber jeder Wasserstoff hat eine Oxidationszahl von +1.
Contributions & Attributions
Diese Seite wurde aus Inhalten der folgenden Mitwirkenden erstellt und vom LibreTexts-Entwicklungsteam (aktuell oder ausführlich) bearbeitet, um Stil, Präsentation und Qualität der Plattform zu erfüllen:CK-12 Foundation von Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson und Jean Dupon.