Lernziele
- Verwenden Sie die Zellnotation, um galvanische Zellen zu beschreiben
- Beschreiben Sie die Grundkomponenten galvanischer Zellen\
Galvanische Zellen, auch voltaische Zellen genannt, sind elektrochemische Zellen, in denen spontane Oxidations-Reduktions-Reaktionen elektrische Energie erzeugen. Beim Schreiben der Gleichungen ist es oft zweckmäßig, die Oxidations-Reduktions-Reaktionen in Halbreaktionen zu unterteilen, um den Ausgleich der Gesamtgleichung zu erleichtern und die tatsächlichen chemischen Umwandlungen hervorzuheben.
Überlegen Sie, was passiert, wenn ein sauberes Stück Kupfermetall in eine Lösung von Silbernitrat gegeben wird (Abbildung \(\pageIndex{1}\)). Sobald das Kupfermetall zugegeben wird, beginnt sich Silbermetall zu bilden und Kupferionen gelangen in die Lösung. Die blaue Farbe der Lösung ganz rechts zeigt das Vorhandensein von Kupferionen an. Die Reaktion kann in zwei Halbreaktionen aufgeteilt werden. Halbreaktionen trennen die Oxidation von der Reduktion, so dass jede einzeln betrachtet werden kann.
Die Gleichung für die Reduktionshalbreaktion musste verdoppelt werden, so dass die Anzahl der in der Reduktionshalbreaktion „gewonnenen“ Elektronen der Anzahl der in der Oxidationshalbreaktion „verlorenen“ Elektronen entsprach.

Galvanische oder voltaische Zellen beinhalten spontane elektrochemische Reaktionen, bei denen die Halbreaktionen getrennt sind (Abbildung \(\pageIndex{2}\)), so dass Strom durch einen externen Draht fließen kann. Das Becherglas auf der linken Seite der Figur wird als Halbzelle bezeichnet und enthält eine 1 M Lösung von Kupfer (II) -nitrat mit einem Stück Kupfermetall, das teilweise in die Lösung eingetaucht ist. Das Kupfermetall ist eine Elektrode. Das Kupfer wird oxidiert; Daher ist die Kupferelektrode die Anode. Die Anode ist mit einem Draht mit einem Voltmeter verbunden und der andere Anschluss des Voltmeters ist mit einem Draht mit einer Silberelektrode verbunden. Das Silber wird reduziert; Daher ist die Silberelektrode die Kathode. Die Halbzelle auf der rechten Seite der Figur besteht aus der Silberelektrode in einer 1 M Lösung von Silbernitrat (AgNO3). An diesem Punkt fließt kein Strom — das heißt, es tritt keine signifikante Bewegung von Elektronen durch den Draht auf, weil der Stromkreis offen ist. Der Stromkreis wird mit einer Salzbrücke geschlossen, die den Strom mit sich bewegenden Ionen überträgt. Die Salzbrücke besteht aus einer konzentrierten, nicht reaktiven Elektrolytlösung wie der in diesem Beispiel verwendeten Natriumnitrat (NaNO3)-Lösung. Während Elektronen von links nach rechts durch die Elektrode und den Draht fließen, gelangen Nitrationen (Anionen) durch den porösen Stopfen links in die Kupfer (II) -Nitratlösung. Dies hält den Becher links elektrisch neutral, indem die Ladung der Kupfer (II) -Ionen neutralisiert wird, die in der Lösung erzeugt werden, wenn das Kupfermetall oxidiert wird. Gleichzeitig bewegen sich die Nitrationen nach links, Natriumionen (Kationen) nach rechts, durch den porösen Pfropfen und in die Silbernitratlösung rechts. Diese hinzugefügten Kationen „ersetzen“ die Silberionen, die aus der Lösung entfernt werden, da sie zu Silbermetall reduziert wurden, wodurch das Becherglas elektrisch neutral bleibt. Ohne die Salzbrücke würden die Kompartimente nicht elektrisch neutral bleiben und kein nennenswerter Strom fließen. Wenn die beiden Kompartimente jedoch in direktem Kontakt stehen, ist eine Salzbrücke nicht erforderlich. In dem Moment, in dem der Stromkreis abgeschlossen ist, liest das Voltmeter +0,46 V, dies wird als Zellpotential bezeichnet. Das Zellpotential entsteht, wenn die beiden unterschiedlichen Metalle verbunden sind, und ist ein Maß für die Energie pro Ladungseinheit, die aus der Oxidations-Reduktions-Reaktion zur Verfügung steht. Das Volt ist die abgeleitete SI-Einheit für elektrisches Potential
\
In dieser Gleichung ist A der Strom in Ampere und C die Ladung in Coulombs. Beachten Sie, dass Volt mit der Ladung in Coulombs (C) multipliziert werden muss, um die Energie in Joule (J) zu erhalten.
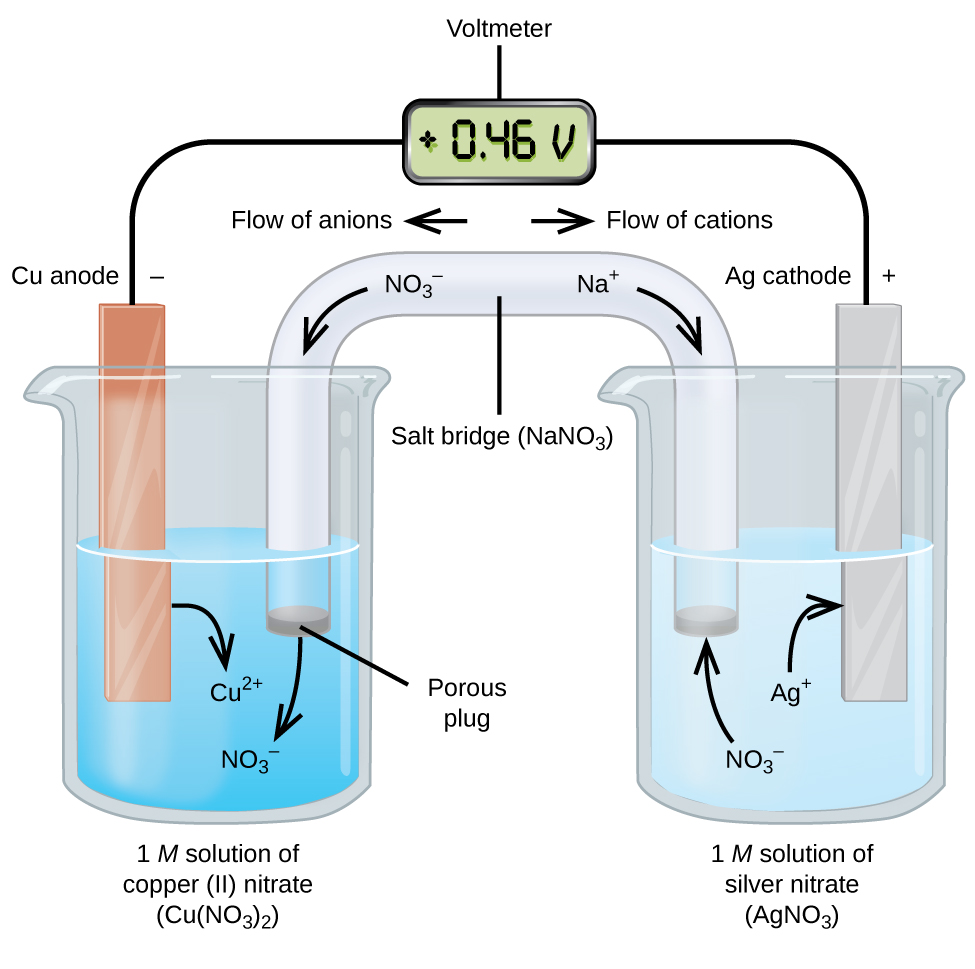
Wenn die elektrochemische Zelle auf diese Weise aufgebaut ist, zeigt ein positives Zellpotential eine spontane Reaktion an und dass die Elektronen von links nach rechts fließen. In Abbildung \(\pageIndex{2}\) ist viel los, daher ist es nützlich, die Dinge für dieses System zusammenzufassen:
- Elektronen fließen von der Anode zur Kathode: von links nach rechts in der galvanischen Standardzelle in der Abbildung.
- Die Elektrode in der linken Halbzelle ist die Anode, da hier Oxidation auftritt. Der Name bezieht sich auf den Fluss von Anionen in der Salzbrücke zu ihm.
- Die Elektrode in der rechten Halbzelle ist die Kathode, da hier Reduktion stattfindet. Der Name bezieht sich auf den Fluss von Kationen in der Salzbrücke zu ihm.
- Oxidation tritt an der Anode auf (die linke Halbzelle in der Abbildung).
- Die Reduktion erfolgt an der Kathode (die rechte Halbzelle in der Abbildung).
- Das Zellpotential von +0,46 V ergibt sich in diesem Fall aus den inhärenten Unterschieden in der Art der Materialien, aus denen die beiden Halbzellen hergestellt wurden.
- Die Salzbrücke muss vorhanden sein, um den Stromkreis zu schließen (zu vervollständigen), und sowohl eine Oxidation als auch eine Reduktion müssen auftreten, damit Strom fließen kann.
Es gibt viele mögliche galvanische Zellen, daher wird normalerweise eine Kurzschreibweise verwendet, um sie zu beschreiben. Die Zellnotation (manchmal auch als Zelldiagramm bezeichnet) liefert Informationen über die verschiedenen an der Reaktion beteiligten Spezies. Diese Notation funktioniert auch für andere Zelltypen. Eine vertikale Linie │ bezeichnet eine Phasengrenze und eine doppelte Linie ‖ die Salzbrücke. Informationen über die Anode werden nach links geschrieben, gefolgt von der Anodenlösung, dann der Salzbrücke (falls vorhanden), dann der Kathodenlösung und schließlich Informationen über die Kathode nach rechts. Die Zellnotation für die galvanische Zelle in Abbildung \(\pageIndex{2}\) lautet dann
\
Beachten Sie, dass die Ionen nicht enthalten sind und dass die einfachste Form jeder Halbreaktion verwendet wurde. Wenn bekannt, sind in der Regel die Anfangskonzentrationen der verschiedenen Ionen enthalten.
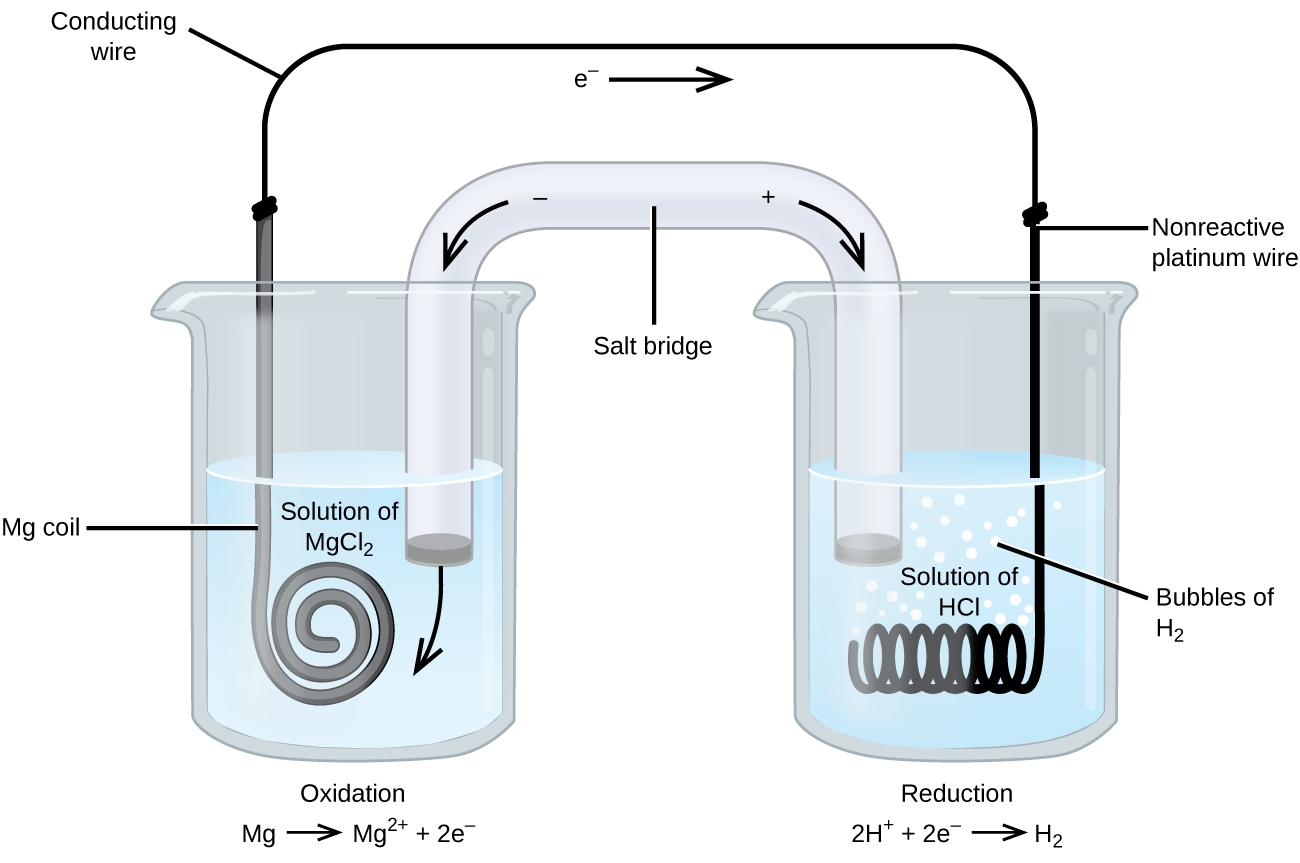
Eine der einfachsten Zellen ist die Daniell-Zelle. Es ist möglich, diese Batterie zu konstruieren, indem eine Kupferelektrode am Boden eines Gefäßes platziert und das Metall mit einer Kupfersulfatlösung bedeckt wird. Eine Zinksulfatlösung wird auf die Kupfersulfatlösung geschwemmt; Dann wird eine Zinkelektrode in die Zinksulfatlösung gegeben. Durch Verbinden der Kupferelektrode mit der Zinkelektrode kann ein elektrischer Strom fließen. Dies ist ein Beispiel für eine Zelle ohne Salzbrücke, und Ionen können über die Grenzfläche zwischen den beiden Lösungen fließen.Einige Oxidations-Reduktions-Reaktionen beinhalten Spezies, die schlechte elektrische Leiter sind, und so wird eine Elektrode verwendet, die nicht an den Reaktionen teilnimmt. Häufig besteht die Elektrode aus Platin, Gold oder Graphit, die alle gegenüber vielen chemischen Reaktionen inert sind. Ein solches System ist in Abbildung \(\pageIndex{3}\) dargestellt. Magnesium wird an der Anode links in der Abbildung oxidiert und Wasserstoffionen werden an der Kathode rechts reduziert. Die reaktion kann zusammengefasst werden als
Die zelle verwendet eine inerte platin draht für die kathode, so die zelle notation ist
Die magnesium elektrode ist eine aktive elektrode weil es beteiligt sich in die oxidation-reduktion reaktion. Inerte Elektroden, wie die Platinelektrode in Abbildung \(\pageIndex{3}\), nehmen nicht an der Oxidations-Reduktions-Reaktion teil und sind vorhanden, so dass Strom durch die Zelle fließen kann. Platin oder Gold sind im Allgemeinen gute inerte Elektroden, da sie chemisch nicht reaktiv sind.
Beispiel \(\pageIndex{1}\): Verwenden der Zellnotation
Betrachten Sie eine galvanische Zelle, die aus
\
Schreiben Sie die Oxidations- und Reduktionshalbreaktionen und schreiben Sie die Reaktion mit der Zellnotation. Welche Reaktion findet an der Anode statt? Die Kathode?
Lösung
Durch Inspektion wird Cr oxidiert, wenn drei Elektronen verloren gehen, um Cr3 + zu bilden, und Cu2+ wird reduziert, wenn es zwei Elektronen gewinnt, um Cu zu bilden. Der Ausgleich der Ladung ergibt
\
Die Zellnotation verwendet die einfachste Form jeder der Gleichungen und beginnt mit der Reaktion an der Anode. Es wurden also keine Konzentrationen angegeben:
\
Oxidation tritt an der Anode und Reduktion an der Kathode auf.
Beispiel \(\pageIndex{2}\): Verwenden der Zellnotation
Betrachten Sie eine galvanische Zelle bestehend aus
Schreiben Sie die Oxidations- und Reduktionshalbreaktionen und schreiben Sie die Reaktion mit der Zellnotation. Welche Reaktion findet an der Anode statt? Die Kathode?
Lösung
Durch Inspektion wird Fe2+ oxidiert, wenn ein Elektron verloren geht, um Fe3 + zu bilden, und MnO4− wird reduziert, wenn es fünf Elektronen gewinnt, um Mn2 + zu bilden. Der Ausgleich der Ladung ergibt
\
Die Zellnotation verwendet die einfachste Form jeder der Gleichungen und beginnt mit der Reaktion an der Anode. Es ist notwendig, eine inerte Elektrode wie Platin zu verwenden, da kein Metall vorhanden ist, um die Elektronen von der Anode zur Kathode zu leiten. Es wurden also keine Konzentrationen angegeben:
\
Oxidation tritt an der Anode und Reduktion an der Kathode auf.
Übung \(\pageIndex{1}\)
Verwenden Sie die Zellnotation, um die galvanische Zelle zu beschreiben, in der Kupfer(II) -Ionen zu Kupfermetall reduziert und Zinkmetall zu Zinkionen oxidiert wird.
Antwort
Aus den im Problem angegebenen Informationen:
\
Verwendung der Zellnotation:
\
Zusammenfassung
Elektrochemische Zellen bestehen typischerweise aus zwei Halbzellen. Die Halbzellen trennen die Oxidationshalbreaktion von der Reduktionshalbreaktion und ermöglichen den Stromfluss durch einen externen Draht. Eine Halbzelle, normalerweise auf der linken Seite in einer Figur dargestellt, enthält die Anode. Oxidation tritt an der Anode auf. Die Anode ist mit der Kathode in der anderen Halbzelle verbunden, oft auf der rechten Seite in einer Figur gezeigt. Die Reduktion erfolgt an der Kathode. Das Hinzufügen einer Salzbrücke vervollständigt die Schaltung, so dass Strom fließen kann. Anionen in der Salzbrücke fließen zur Anode und Kationen in der Salzbrücke fließen zur Kathode. Die Bewegung dieser Ionen vervollständigt den Kreislauf und hält jede Halbzelle elektrisch neutral. Elektrochemische Zellen können mit Zellnotation beschrieben werden. In dieser Notation erscheinen links Informationen über die Reaktion an der Anode und rechts Informationen über die Reaktion an der Kathode. Die Salzbrücke wird durch eine doppelte Linie dargestellt, ‖. Die festen, flüssigen oder wässrigen Phasen innerhalb einer Halbzelle sind jeweils durch eine einzige Leitung getrennt. Die Phase und Konzentration der verschiedenen Arten ist nach dem Artnamen enthalten. Elektroden, die an der Oxidations-Reduktions-Reaktion teilnehmen, werden als aktive Elektroden bezeichnet. Elektroden, die nicht an der Oxidations-Reduktions-Reaktion teilnehmen, aber dazu da sind, Strom fließen zu lassen, sind inerte Elektroden. Inerte Elektroden bestehen häufig aus Platin oder Gold, die durch viele chemische Reaktionen unverändert bleiben.
Glossar
aktive Elektrode Elektrode, die an der Oxidations-Reduktions-Reaktion einer elektrochemischen Zelle beteiligt ist; die Masse einer aktiven Elektrode ändert sich während der Oxidations-Reduktions-Reaktion Anodenelektrode in einer elektrochemischen Zelle, an der Oxidation auftritt; informationen über die Anode werden auf der linken Seite der Salzbrücke in Zellnotation aufgezeichnet Kathodenelektrode in einer elektrochemischen Zelle, an der eine Reduktion auftritt; Informationen über die Kathode werden auf der rechten Seite der Salzbrücke in Zellnotation aufgezeichnet Zellnotation Kurzform zur Darstellung der Reaktionen in einer elektrochemischen Zelle Zellpotentialdifferenz im elektrischen Potential, die entsteht, wenn unterschiedliche Metalle miteinander verbunden sind; die treibende Kraft für den Fluss der Ladung (Strom) in Oxidations-Reduktions-Reaktionen galvanische Zelle elektrochemische Zelle, die eine spontane Oxidations-Reduktions-Reaktion beinhaltet; elektrochemische Zellen mit positiven Zellpotentialen; auch als voltaische Zelle bezeichnet inerte Elektrode Elektrode, die Strom fließen lässt, aber ansonsten nicht an der Oxidations-Reduktions-Reaktion in einer elektrochemischen Zelle teilnimmt; Die Masse einer inerten Elektrode ändert sich während der Oxidations-Reduktions-Reaktion; inerte Elektroden bestehen häufig aus Platin oder Gold, da diese Metalle chemisch nicht reaktiv sind. voltaische Zelle ein anderer Name für eine galvanische Zelle
Mitwirkende und Zuschreibungen
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) und Richard Langley (Stephen F. Austin State University) mit beitragenden Autoren. Lehrbuchinhalte, die von OpenStax College produziert werden, sind unter einer Creative Commons Attribution License 4.0 Lizenz lizenziert. Kostenlos herunterladen unter http://cnx.org/contents/85abf193-2bd…[email protected]).