Weiter: 3.4 Kühlschränke und Aufheizen: 3. Das erste Gesetz Zurück: 3.2 Verallgemeinerte Darstellung des Inhalts Index
Ein Carnot-Zyklus ist in Abbildung 3.4 dargestellt. Es hasfour Prozesse. Es gibt zwei adiabatische reversible Beine und zweiisothermische reversible Beine. Wir können einen Carnot-Zyklus mit konstruierenviele verschiedene Systeme, aber die Konzepte können mit einem bekannten Arbeitsfluid, dem idealen Gas, gezeigt werden. Das System kann als angesehen Werdenkammer, die von einem Kolben umschlossen und mit diesem idealen Gas gefüllt ist.
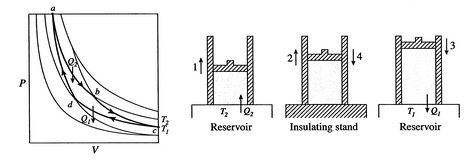
Die vier Prozesse im Carnot-Zyklus sind:
- Das System hat die Temperatur
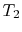 im Zustand
im Zustand  . Es isbrought in Verbindung mit einem Wärmespeicher, der gerade eine Flüssigkeit orsolid Masse des genügend großen Umfangs ist, damit seine Temperatur notchange merklich, wenn irgendeine Wärmemenge thesystem übertragen wird. Mit anderen Worten, der Wärmespeicher ist eine konstante Temperaturquelle (oder Empfänger) von Wärme. Das System erfährt dann eine anisotherme Expansion von
. Es isbrought in Verbindung mit einem Wärmespeicher, der gerade eine Flüssigkeit orsolid Masse des genügend großen Umfangs ist, damit seine Temperatur notchange merklich, wenn irgendeine Wärmemenge thesystem übertragen wird. Mit anderen Worten, der Wärmespeicher ist eine konstante Temperaturquelle (oder Empfänger) von Wärme. Das System erfährt dann eine anisotherme Expansion von  zu
zu 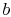 , wobei Wärme absorbiert wird
, wobei Wärme absorbiert wird 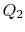 .
. - Atstate
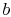 wird das System thermisch isoliert (vom Kontakt mit dem Wärmespeicher entfernt) und dann auf
wird das System thermisch isoliert (vom Kontakt mit dem Wärmespeicher entfernt) und dann auf 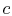 expandieren lassen. Während dieser Ausdehnung sinkt die Temperatur auf
expandieren lassen. Während dieser Ausdehnung sinkt die Temperatur auf 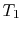 . Die Wärme ausgetauschtwährend dieses Teils des Zyklus,
. Die Wärme ausgetauschtwährend dieses Teils des Zyklus, 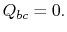 )
) - Im Zustand
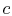 Das System wird in Kontakt mit einem Wärmespeicher bei der Temperatur gebracht
Das System wird in Kontakt mit einem Wärmespeicher bei der Temperatur gebracht 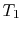 . Es wird dann komprimiert, um
. Es wird dann komprimiert, um 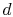 anzugeben und dabei heat
anzugeben und dabei heat 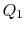 abzulehnen.
abzulehnen. - Schließlich wird das System adiabatisch zurück in den Ausgangszustand komprimiert
 . Der Wärmeaustausch
. Der Wärmeaustausch 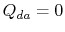 .
.
Der thermische Wirkungsgrad des Zyklus ist gegeben durch die Definition
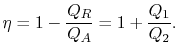 |
(3..4) |
In dieser Gleichung ist eine Vorzeichenkonvention impliziert. Die Größen![]()
![]() wie definiert sind die Größen der absorbierten und projizierten Wärme. Die Mengen
wie definiert sind die Größen der absorbierten und projizierten Wärme. Die Mengen ![]()
![]() hingegen werden in Bezug auf die vom System empfangene Wärme definiert. In diesem Beispiel ist ersterer negativ und letzterer positiv. Die vom System absorbierte und projizierte Wärme findet während isothermer Prozesse statt undWir wissen bereits, welche Werte sie von Gl.(3.1):
hingegen werden in Bezug auf die vom System empfangene Wärme definiert. In diesem Beispiel ist ersterer negativ und letzterer positiv. Die vom System absorbierte und projizierte Wärme findet während isothermer Prozesse statt undWir wissen bereits, welche Werte sie von Gl.(3.1):
Die Effizienz kann nun in Bezug auf die Volumina in den verschiedenen Zuständen geschrieben werden als
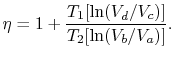 |
(3..5) |
The path from states ![]() to
to ![]() and from
and from ![]() to
to ![]() are bothadiabatic and reversible. For a reversible adiabatic process we knowthat
are bothadiabatic and reversible. For a reversible adiabatic process we knowthat ![]() . Using the ideal gas equation ofstate, we have
. Using the ideal gas equation ofstate, we have ![]() . Along curve
. Along curve![]()
![]() , therefore,
, therefore, ![]() . Alongthe curve
. Alongthe curve ![]()
![]()
![]() . Thus,
. Thus,

Comparing the expression for thermal efficiencyEq. (3.4) with Eq. (3.5) zeigt zwei Konsequenzen. Erstens beziehen sich die empfangenen und abgelehnten Wärmeauf die Temperaturen der isothermen Teile des Zyklus durch
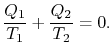 |
(3..6) |
Zweitens ist die Effizienz eines Carnot-Zyklus kompakt gegeben durch
 |
(3..7) |
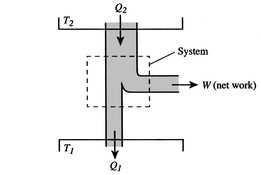
Der Wirkungsgrad kann nur dann 100% betragen, wenn die Temperatur, bei der die Wärme zurückgewiesen wird, Null ist. Die Wärme- und Arbeitsübertragungen zum und vom System sind schematisch in Abbildung 3.5 dargestellt.
Schlammige Punkte
Seit ![]() , Blick auf die
, Blick auf die ![]()
![]() graph, doesthat bedeuten die weiter auseinander die
graph, doesthat bedeuten die weiter auseinander die ![]()
![]() isothermen sind, thegreater effizienz? Und wenn sie sehr nah wären, wäre essehr ineffizient? (MP 3.2)
isothermen sind, thegreater effizienz? Und wenn sie sehr nah wären, wäre essehr ineffizient? (MP 3.2)
Warum haben wir es im Carnot-Zyklus nur mit Volumenänderungen und nicht mit Druckänderungen an den Adiabaten und Isothermen zu tun?(MP 3.3)
Gibt es eine physikalische Anwendung für den Carnot-Zyklus? Können wir einen Carnot-Motor für ein Antriebsgerät entwerfen?(MP 3.4)
Woher wissen wir, welche Zyklen als Modelle für reale Prozesse verwendet werden sollen?(MP 3.5)
Weiter: 3.4 Kühlschränke und Aufheizen: 3. Das erste Gesetz Previous: 3.2 Verallgemeinerte Darstellung des Inhaltsindex
UnifiedTP