Die Hybridisierungstheorie wird oft als langes und verwirrendes Konzept angesehen, und es ist eine praktische Fähigkeit, schnell feststellen zu können, ob das Atom sp3, sp2 oder sp ist, ohne alle Details der Hybridisierung durchgehen zu müssen.
Glücklicherweise gibt es eine Abkürzung, und in diesem Beitrag werde ich versuchen, dies in ein paar verschiedenen Schritten zusammenzufassen, die Sie befolgen müssen.
Angenommen, Sie werden gebeten, den Hybridisierungszustand für die nummerierten Atome im folgenden Molekül zu bestimmen:

Als erstes müssen Sie die Anzahl der Gruppen bestimmen, die sich an jedem Atom befinden. Unter Gruppen verstehen wir entweder Atome oder einzelne Elektronenpaare. Dies wird auch als Sterische Zahl (SN) bezeichnet.

Nachfolgend finden Sie einige Beispiele für die sterischen Zahlen 2-4, die Sie in der organischen Chemie weitgehend kennen müssen:

Beachten Sie, dass Mehrfachbindungen keine Rolle spielen.
Sobald Sie wissen, wie Sie die sterische Zahl bestimmen (sie stammt aus der VSEPR–Theorie), müssen Sie einfach die folgende Korrelation anwenden:
Wenn die sterische Zahl 4 ist, ist es sp3
Wenn die sterische Zahl 3 ist – sp2
Wenn die sterische Zahl 2 – sp ist
Also gehen wir jetzt zurück zu unserem Molekül und bestimmen die Hybridisierungszustände für alle Atome.
C1 – SN = 3 (drei Atome verbunden), daher ist es sp2
C2 – SN = 3 (drei Atome verbunden), daher ist es sp2
O4 – SN = 3 (1 Atom + 2 einsame Paare), daher ist es sp2
O5 – SN = 4 (2 Atome + 2 einsame Paare), daher ist es sp3
C6 – SN = 4 (4 Atome), daher ist es sp3
C7 – SN = 4 (4 Atome), daher ist es sp3
N8 – SN = 4 (3 Atome + 1 einsames Paar), daher ist es sp3
C9 – SN = 2 (2 Atome), daher ist es sp
C10 – SN = 2 (2 Atome), daher ist es sp

Zusätzlich zu bei dieser Methode ist es auch sehr nützlich, sich an einige Merkmale zu erinnern, die mit der Struktur und Hybridisierung zusammenhängen. Im Allgemeinen ist ein Atom mit allen Einfachbindungen ein sp3 hybridisiert. Bestes Beispiel sind die Alkane. Alle Kohlenstoffatome in einem Alkan sind sp3 hybridisiert mit tetraedrischer Geometrie.
Die Kohlenstoffe in Alkenen und anderen Atomen mit einer Doppelbindung sind oft sp2-hybridisiert und haben eine trigonale planare Geometrie.
Die Dreifachbindung hingegen ist charakteristisch für Alkine, bei denen die Kohlenstoffatome sp-hybridisiert sind.
Es gibt einige häufige Ausnahmen von dem, was wir über die Bestimmung des Hybridisierungszustands besprochen haben, und sie beziehen sich hauptsächlich auf die Methode, bei der wir den Bindungstyp des Atoms betrachten.
Zum Beispiel hat der Kohlenstoff im Kohlendioxid (CO2) zwei Doppelbindungen, aber er ist sp-hybridisiert.
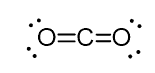
Und der Grund dafür ist die Tatsache, dass die sterische Zahl des Kohlenstoffs zwei ist (es sind nur zwei Sauerstoffatome damit verbunden) und um zwei Atome bei 180o zu halten, was die optimale Geometrie ist, muss der Kohlenstoff zwei identische Orbitale verwenden. Dies ist nur in der sp-Hybridisierung möglich. Die anderen beiden 2p-Orbitale werden zur Herstellung der Doppelbindungen auf jeder Seite des Kohlenstoffs verwendet.
Ein weiteres häufiges und sehr wichtiges Beispiel sind die Carbokationen.

Hier hat der Kohlenstoff nur Einfachbindungen und es kann so aussehen, als ob er sp3-hybridisiert sein soll. Der Kohlenstoff in dieser Art von Carbokationen ist jedoch sp2-hybridisiert. Wieder aus dem gleichen Grund, dass seine sterische Zahl 3 ist (sp2 – drei identische Orbitale).
Eine Ausnahme bei der sterischen Zahlenmethode
Eine Ausnahme bei der sterischen Zahl sind beispielsweise die Amide. Das Stickstoffatom hat hier die sterische Zahl 4 und entspricht sp3. Aufgrund der Resonanzdelokalisierung des einsamen Paares wandelt es sich jedoch von sp3 in sp2 um, da dies die einzige Möglichkeit ist, die Elektronen in einem ausgerichteten p-Orbital zu haben, das sich mit den Pi-Bindungselektronen der C = O-Doppelbindung überlappen und an der Resonanzstabilisierung teilnehmen kann.

In den meisten Fällen müssen Sie sich keine Gedanken über die Ausnahmen machen, wenn Sie auf der Grundlage der sterischen Nummer gehen.