Mechanismen der enzymatischen Katalyse
Die Bindung eines Substrats an das aktive Zentrum eines Enzyms ist eine sehr spezifische Wechselwirkung. Aktive Zentren sind Spalten oder Rillen auf der Oberfläche eines Enzyms, die normalerweise aus Aminosäuren aus verschiedenen Teilen der Polypeptidkette bestehen, die in der Tertiärstruktur des gefalteten Proteins zusammengeführt werden. Substrate binden zunächst durch nichtkovalente Wechselwirkungen an das aktive Zentrum, einschließlich Wasserstoffbrückenbindungen, Ionenbindungen und hydrophobe Wechselwirkungen. Sobald ein Substrat an das aktive Zentrum eines Enzyms gebunden ist, können mehrere Mechanismen seine Umwandlung in das Reaktionsprodukt beschleunigen.Obwohl das einfache Beispiel, das im vorherigen Abschnitt besprochen wurde, nur ein einzelnes Substratmolekül umfasste, beinhalten die meisten biochemischen Reaktionen Wechselwirkungen zwischen zwei oder mehr verschiedenen Substraten. Zum Beispiel beinhaltet die Bildung einer Peptidbindung die Verbindung von zwei Aminosäuren. Bei solchen Reaktionen beschleunigt die Bindung von zwei oder mehr Substraten an das aktive Zentrum in der richtigen Position und Orientierung die Reaktion (Abbildung 2.23). Das Enzym liefert eine Vorlage, auf der die Reaktanten zusammengebracht und richtig ausgerichtet werden, um die Bildung des Übergangszustands zu begünstigen, in dem sie interagieren.

Abbildung 2.23
Enzymatische Katalyse einer Reaktion zwischen zwei Substraten. Das Enzym liefert eine Vorlage, auf der die beiden Substrate in der richtigen Position und Orientierung zusammengebracht werden, um miteinander zu reagieren.
Enzyme beschleunigen Reaktionen auch, indem sie die Konformation ihrer Substrate verändern, um sich der des Übergangszustands zu nähern. Das einfachste Modell der Enzym-Substrat-Interaktion ist das Lock-and-Key-Modell, bei dem das Substrat genau in das aktive Zentrum passt (Abbildung 2.24). In vielen Fällen werden jedoch die Konfigurationen sowohl des Enzyms als auch des Substrats durch Substratbindung modifiziert — ein Prozess, der als induzierte Anpassung bezeichnet wird. In solchen Fällen wird die Konformation des Substrats so verändert, dass es der des Übergangszustands ähnlicher ist. Die Spannung, die durch eine solche Verzerrung des Substrats erzeugt wird, kann seine Umwandlung in den Übergangszustand weiter erleichtern, indem kritische Bindungen geschwächt werden. Darüber hinaus wird der Übergangszustand durch seine enge Bindung an das Enzym stabilisiert, wodurch die erforderliche Aktivierungsenergie verringert wird.

Abbildung 2.24
Modelle der Enzym-Substrat-Interaktion. (A) Im Schloss- und-Schlüssel-Modell passt das Substrat genau in das aktive Zentrum des Enzyms. (B) Im Induced-Fit-Modell verzerrt die Substratbindung die Konformationen von Substrat und Enzym. Diese Verzerrung (mehr…)
Neben der Zusammenführung mehrerer Substrate und der Verzerrung der Konformation von Substraten, um sich dem Übergangszustand zu nähern, nehmen viele Enzyme direkt am katalytischen Prozess teil. In solchen Fällen können spezifische Aminosäureseitenketten im aktiven Zentrum mit dem Substrat reagieren und Bindungen mit Reaktionszwischenprodukten bilden. Die sauren und basischen Aminosäuren sind häufig an diesen katalytischen Mechanismen beteiligt, wie in der folgenden Diskussion von Chymotrypsin als Beispiel für enzymatische Katalyse dargestellt.
Chymotrypsin gehört zu einer Familie von Enzymen (Serinproteasen), die Proteine verdauen, indem sie die Hydrolyse von Peptidbindungen katalysieren. Die Reaktion kann wie folgt geschrieben werden:

Die verschiedenen Mitglieder der Serinprotease-Familie (einschließlich Chymotrypsin, Trypsin, Elastase und Thrombin) weisen unterschiedliche Substratspezifitäten auf; sie spalten bevorzugt Peptidbindungen, die an verschiedene Aminosäuren angrenzen. Während beispielsweise Chymotrypsin Bindungen neben hydrophoben Aminosäuren wie Tryptophan und Phenylalanin verdaut, verdaut Trypsin Bindungen neben basischen Aminosäuren wie Lysin und Arginin. Alle Serinproteasen sind jedoch ähnlich aufgebaut und verwenden den gleichen Katalysemechanismus. Die aktiven Stellen dieser Enzyme enthalten drei kritische Aminosäuren – Serin, Histidin und Aspartat —, die die Hydrolyse der Peptidbindung vorantreiben. In der Tat werden diese Enzyme aufgrund der zentralen Rolle des Serinrestes als Serinproteasen bezeichnet.
Substrate binden an die Serinproteasen durch Insertion der Aminosäure neben der Schnittstelle in eine Tasche an der aktiven Stelle des Enzyms (Abbildung 2.25). Die Art dieser Tasche bestimmt die Substratspezifität der verschiedenen Mitglieder der Serinprotease-Familie. Beispielsweise enthält die Bindungstasche von Chymotrypsin hydrophobe Aminosäuren, die mit den hydrophoben Seitenketten seiner bevorzugten Substrate interagieren. Im Gegensatz dazu enthält die Bindungstasche von Trypsin eine negativ geladene saure Aminosäure (Aspartat), die mit den Lysin- oder Argininresten ihrer Substrate eine ionische Bindung eingehen kann.
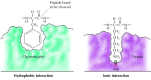
Abbildung 2.25
Substratbindung durch Serinproteasen. Die an die zu spaltende Peptidbindung angrenzende Aminosäure wird in eine Tasche an der aktiven Stelle des Enzyms eingeführt. In Chymotrypsin bindet die Tasche hydrophobe Aminosäuren; Die Bindungstasche von Trypsin enthält (mehr…)
Die Substratbindung positioniert die zu spaltende Peptidbindung neben dem Serin der aktiven Stelle (Abbildung 2.26). Das Proton dieses Serins wird dann auf das aktive Zentrum Histidin übertragen. Die Konformation des aktiven Zentrums begünstigt diesen Protonentransfer, da das Histidin mit dem negativ geladenen Aspartatrest interagiert. Das Serin reagiert mit dem Substrat und bildet einen tetraedrischen Übergangszustand. Die Peptidbindung wird dann gespalten, und der C-terminale Teil des Substrats wird aus dem Enzym freigesetzt. Das N-terminale Peptid bleibt jedoch an Serin gebunden. Diese Situation wird gelöst, wenn ein Wassermolekül (das zweite Substrat) in das aktive Zentrum eintritt und die vorhergehenden Reaktionen umkehrt. Das Proton des Wassermoleküls wird auf Histidin übertragen, und seine Hydroxylgruppe wird auf das Peptid übertragen, wodurch ein zweiter tetraedrischer Übergangszustand gebildet wird. Das Proton wird dann von Histidin zurück zu Serin übertragen, und das Peptid wird aus dem Enzym freigesetzt, wodurch die Reaktion abgeschlossen wird.

Abbildung 2.26
Katalytischer Mechanismus von Chymotrypsin. Drei Aminosäuren am aktiven Zentrum (Ser-195, His-57 und Asp-102) spielen eine entscheidende Rolle bei der Katalyse.
Dieses Beispiel veranschaulicht mehrere Merkmale der enzymatischen Katalyse; die Spezifität der Enzym-Substrat-Wechselwirkungen, die Positionierung verschiedener Substratmoleküle im aktiven Zentrum und die Beteiligung von Resten des aktiven Zentrums an der Bildung und Stabilisierung des Übergangszustands. Obwohl die Tausenden von Enzymen in Zellen viele verschiedene Arten chemischer Reaktionen katalysieren, gelten für ihre Funktionsweise die gleichen Grundprinzipien.