Delokalisierung tritt auf, wenn die elektrische Ladung über mehr als ein Atom verteilt ist. Beispielsweise können Bindungselektronen auf mehrere Atome verteilt sein, die miteinander verbunden sind.

Beispiel 1:
Eines der bekanntesten Beispiele für ein Molekül, in dem Bindungselektronen delokalisiert sind, ist Benzol, siehe unten:
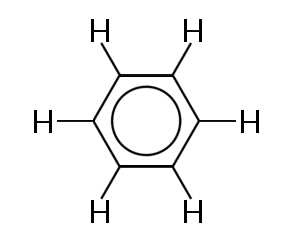
Benzol besteht aus einem Ring von sechs Kohlenstoffatomen. Die Kohlenstoffatome sind alle sp2 hybridisiert mit einem unhybridisierten p-Orbital.
Die sp2-Hybridorbitale erzeugen normale kovalente Bindungen, manchmal auch σ-Bindungen genannt: Dies sind die einzelnen CC-Bindungen und einzelnen CC-Bindungen.Dadurch verbleibt jedem Kohlenstoff ein Elektron in einem p-Orbital im rechten Winkel zur Ringebene.
Im Diagramm unten sehen Sie links die sp2-Orbitale, die kovalente Bindungen bilden. Rechts sehen Sie die p-Orbitale, von denen jedes ein Elektron enthält.
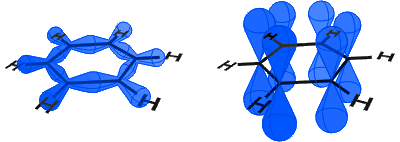
Die p-Orbitale verbinden sich Seite an Seite und die Elektronen in den p-Orbitalen werden als π-Elektronen beschrieben.
Im Diagramm unten haben sich die p-Orbitale kombiniert und die π-Elektronen sind delokalisiert. Im Durchschnitt sind alle Ringbindungen identisch.
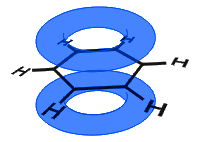
Anders als im folgenden Beispiel werden die delokalisierten Elektronen in Benzol im Molekül gehalten und können sich nicht frei durch das Schüttgut bewegen.
Beispiel 2: Metalle haben eine hohe thermische und elektrische Leitfähigkeit, da die äußersten Elektronen in ihren Atomen delokalisiert sind. Diese Elektronen sind keinem bestimmten metallischen Kern zugeordnet und können sich daher frei im Metall bewegen.
Danksagung: Die blau gefärbten Bilder der Benzol-Orbitale sind mit freundlicher Genehmigung von Sansculotte. Diese Bilder sind unter der Creative Commons Attribution-Share Alike 1.0 Generic License lizenziert.