Eine voltaische Zelle, oft als galvanische Zelle bezeichnet, liefert elektrische Energie. Die Quelle dieser Energie ist eine spontane chemische Reaktion, genauer gesagt eine spontane Redoxreaktion.Zum Beispiel bestehen alle Batterien aus einer oder mehreren voltaischen Zellen;Batterien gehen leer, wenn die meisten oder alle ihrer Reaktanten in Produkte umgewandelt wurden, die ihre chemische potentielle Energie in elektrische Energie umwandeln.
Voltaische Zellen – Der grundlegende Prozess
Chemische potentielle Energie → Elektrische Energie
Die voltaische Zelle ist eine von zwei Grundtypen elektrochemischer Zellen.Der andere Typ ist die Elektrolysezelle; In einer Elektrolysezelle wird elektrische Energie verwendet, um eine nicht spontane chemische Reaktion anzutreiben.Beispielsweise kann Wasser in einer Elektrolysezelle in Wasserstoff und Sauerstoff gespalten werden. Wenn eine wiederaufladbare Batterie aufgeladen wird, arbeitet sie auch als Elektrolysezelle.
Basic Voltaic Cell Schematic

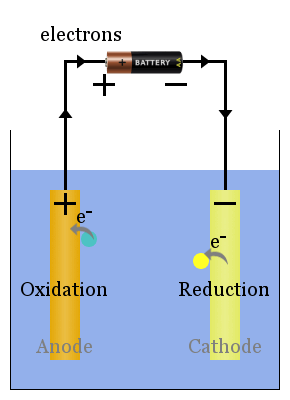
Spontane Redoxreaktionen an den Elektroden erzeugen eine Spannung.Richtig eingestellt, Diese Spannung kann Elektronen durch elektrische Geräte treiben, wie die Glühbirne gezeigt here.In auf diese Weise übertragen sie Elektronen zur Anode, von wo aus sie durch die Glühbirne zur Kathode fließen, wo sie eine Reduktion bewirken.
Grundlegende Elektrolysezelle Schematische
Nicht-spontane redox reaktionen sind angetrieben durch eine externe spannung.Die Prozesse der Elektrolysezelle sind das Gegenteil der voltaischen Zelle.Der Strom von der Stromquelle drückt Elektronen zur Kathode, wo sie eine Reduktion der Spezies bewirken.
Lesen Sie hier mehr über Kathoden und Anoden in voltaischen vs. elektrolytischen Zellen.
Beispiel einer voltaischen Zelle
Die Edison-Batterie
Die Edison-Batterie ist eine einfache, wiederaufladbare Zelle, die von Thomas Edison.It besteht aus zwei Metallelektroden, eine aus Eisen, die andere aus Nickel.Während des ersten Ladens bildet sich auf der Nickelelektrode eine Beschichtung aus Nickeloxid.
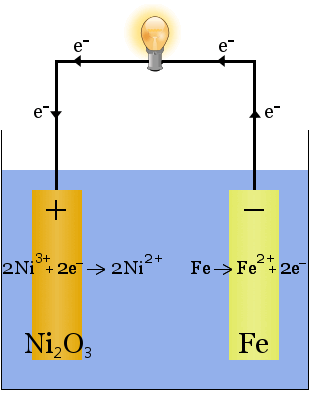
Der Elektrolyt (die ionische Flüssigkeit zwischen den Elektroden) ist 20-30 Gewichtsprozent Kaliumhydroxid in Wasser.Die Rolle des Kaliumhydroxids besteht in diesem Fall darin, die Ionenleitfähigkeit zu erhöhen, um den Stromkreis zu vervollständigen – Kaliumhydroxid wird bei der Reaktion nicht verbraucht.
Beim Entladen arbeitet die Edison-Zelle als voltaische Zelle.Wenn sie geladen wird, arbeitet die Zelle als Elektrolysezelle.
Die chemischen Gleichungen für die Reaktionen an den Elektroden sind:
Während der Entladung, wenn die Zelle elektrische Energie liefert, gehen die obigen Reaktionen nach rechts →.
Während des Ladevorgangs, wenn die Zelle elektrische Energie in chemische potentielle Energie umwandelt, gehen die obigen Reaktionen nach links ←.
Die Edison-Zelle, bei der sich beide Elektroden den gleichen Elektrolyten teilen, ist eine der einfachsten voltaischen Zellen im praktischen Gebrauch; die meisten voltaischen Zellen sind komplizierter.Seine großen Vorteile sind seine bemerkenswerte Robustheit gegen Fehler wie Überladung und seine sehr lange Lebensdauer mit nahezu unbegrenzten Lade-Entlade-Zyklen.
Sein größter Nachteil ist, dass es im Verhältnis zu seiner Energieabgabe sehr schwer ist.
Weiteres Beispiel
Lithiumbatterien
Fortschritte in der Batterietechnologie haben die Miniaturisierung elektronischer Geräte vorangetrieben.Ohne diese Fortschritte wären moderne Geräte wie Handys und Tablets größer und umständlicher.
Im Mittelpunkt dieser Fortschritte stand die Lithium-Ionen-Technologie.Das Element Lithium ist ein Metall mit sehr geringer Dichte: Mit 0,534 g/cm3 ist Lithium halb so dicht wie Wasser; Lithium schwimmt auf Wasser.Vergleichen Sie dies mit den Metallen in der Edison-Zelle, die Dichte von Nickel beträgt 8,908 g / cm3 und die von Eisen 7,874 g / cm3: Diese sind mehr als 10x höher als die Dichte von Lithium.
Das hohe Redoxpotential von Lithium in Kombination mit seiner geringen Dichte macht seine Ionen perfekt für den Einsatz als Batteriematerial.
Eine typische Lithium-Ionen-Batterie basiert auf porösen Elektroden, die es Li-Ionen ermöglichen, sich in ihre Poren hinein und aus ihnen heraus zu bewegen.Beispielsweise könnte eine wiederaufladbare Lithiumionenbatterie eine Graphitelektrode und eine lithiumdotierte Kobaltoxidelektrode mit einem Polyoxyethylenelektrolyten aufweisen, der das Salz LiPF6 enthält.
Wenn eine solche Batterie ein Gerät antreibt, werden Lithiumatome, die in der Schichtstruktur der Graphitanode gehalten werden, zu Ionen oxidiert.
An der Kathode werden Lithiumionen innerhalb der Kobaltoxidstruktur reduziert.
These reactions are reversed when the cell is being charged.
