U.S. Pharm. 2008;33(4)(Onkologie suppl): 20-30. Ungefähr 75% der postmenopausalen Frauen mit Brustkrebs haben eine Hormonrezeptor-positive (HR +) Erkrankung.1 Tamoxifen war der Standard der Therapie für HR + Brustkrebs bei postmenopausalen Frauen bis zum Aufkommen der selektiven Aromatasehemmer der dritten Generation, die Anastrozol, Letrozol und Exemestan sind.3,4 Diese Wirkstoffe haben in klinischen Studien im Vergleich zu Tamoxifen ein überlegenes krankheitsfreies Überleben gezeigt, aber ihr Nutzen bei mehr als fünfjähriger Anwendung bei postmenopausalen Frauen mit HR + -Brustkrebs wurde nicht nachgewiesen.3,4
Es wurde geschätzt, dass drei Viertel der postmenopausalen Frauen mit Brustkrebs eine hormonrezeptor-positive (HR +) Erkrankung haben.1 Tamoxifen–ein selektiver Östrogenempfängermodulator mit estrogenic Effekten auf Knochen, Endometriumgewebe und Lipide und Anti!= östrogene Wirkungen auf das Brustgewebe – war die Standardtherapie für HR + Brustkrebs bei postmenopausalen Frauen bis zur Einführung der selektiven Aromatasehemmer der dritten Generation (AIs).2-4 Diese Wirkstoffe – Anastrozol, Letrozol und Exemestan – haben in klinischen Studien ein überlegenes krankheitsfreies Überleben (DFS) im Vergleich zu Tamoxifen gezeigt.3,4 Nebenwirkungen im Zusammenhang mit der Anwendung von Tamoxifen – Endometriumkarzinom, thromboembolische Komplikationen und Tamoxifenresistenz – haben die Entwicklung von Therapien mit einem anderen Wirkmechanismus wie dem AIs gefördert.2
In TABELLE 1 finden Sie eine Zusammenfassung wichtiger Informationen zum AIs der dritten Generation.
Hintergrund
Der schottische Chirurg George Beatson beschrieb 1896 den hormonellen Beitrag von Östrogenen zur Karzinogenese in Bezug auf Brustkrebs.5 Beatson erkannte, dass die Entfernung der Eierstöcke (Oophorektomie) bei Frauen mit inoperablem Brustkrebs von Vorteil war.5 Dieser chirurgisch induzierte Zustand des Östrogenentzugs trug zur Hemmung des Tumorwachstums in Brustkrebszellen bei Frauen mit HR + -Krankheit bei.5
Aminoglutethimid, ursprünglich als Antikonvulsivum formuliert, war die erste unspezifische KI, die ursprünglich in den späten 1970er Jahren als Second-Line-Agent nach Tamoxifen für postmenopausale Frauen mit fortgeschrittenem HR + Brustkrebs gefördert wurde.6 Toxische Nebenwirkungen wie Nebennierensuppression und die Notwendigkeit einer Steroidtherapie führten zum Rückzug von Aminoglutethimid vom Markt.6 Bei postmenopausalen Frauen mit HR + -Brustkrebs im Früh- und Spätstadium weisen die AIs der dritten Generation im Vergleich zu den älteren Wirkstoffen ein besseres Toxizitätsprofil, eine höhere Selektivität, eine höhere Wirksamkeit und eine verbesserte klinische Wirksamkeit auf. 6
Klassifizierung4,7
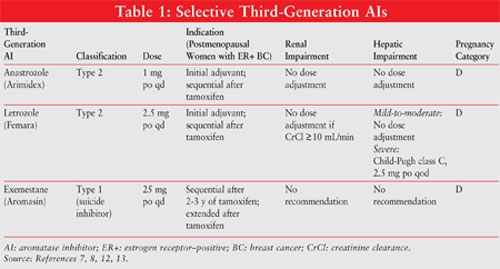
AIs werden als steroidale (nicht kompetitive, irreversible) oder nichtsteroidale (kompetitive, reversible) Inhibitoren vom Typ 1 klassifiziert. Exemestan, ein Typ-1-Inhibitor, bindet irreversibel an die Stelle des Aromatasemoleküls und ist als Suizidhemmer bekannt. Die Typ-2-Inhibitoren Anastrozol und Letrozol binden reversibel an Aromatase. Siehe ABBILDUNG 1 für die chemischen Strukturen der verschiedenen AIs.
Wirkmechanismus
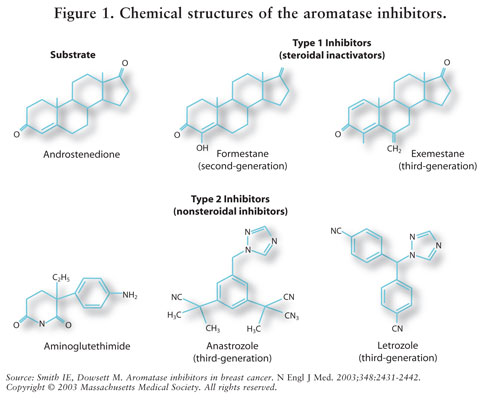
Die Östrogensynthese wird durch das Enzym Aromatase vermittelt.7 Aromatase wandelt Androstendion und Testosteron in Östron und Östradiol um.5,7 AIs reduzieren Östrogen bei postmenopausalen Frauen und hemmen dadurch seine krebserzeugende Wirkung auf das Brustgewebe.7 Da die Eierstöcke prämenopausaler Frauen immer noch funktionieren, sind AIs für diese Population außerhalb klinischer Studien nicht indiziert; Bei diesen Frauen würde AIs den Hypothalamus und die Hypophyse stimulieren, um die Produktion von Gonadotropinen zu erhöhen.4 Siehe ABBILDUNG 2.
Toxizitäten6,8
Zu den Nebenwirkungen von AIs gehören kardiovaskuläre Funktionsstörungen wie Bluthochdruck, Vasodilatation, Ödeme und Brustschmerzen. Weitere Studien sind erforderlich, um die volle Wirkung von AIs auf die Herzfunktion zu bewerten. Bei Patienten kann es zu einer verminderten Knochenmineraldichte (BMD), einem erhöhten Frakturrisiko, vasomotorischen Symptomen, vaginaler Trockenheit, Schmerzen des Bewegungsapparates, Kopfschmerzen, Schlaflosigkeit, Depressionen, erhöhtem Husten, Atemnot, Magen-Darm-Beschwerden, Gewichtszunahme und möglicherweise erhöhten Lipidspiegeln kommen. Knochenschwund ist eine vorherrschende Nebenwirkung; Bisphosphonate wie Zoledronsäure wurden verwendet, um dem entgegenzuwirken. Patienten mit AIs sollten eine Vitamin-D- und Kalziumergänzung erhalten. Langwierige Nebenwirkungen und Auswirkungen der KI-Therapie auf die kognitive Funktion wurden noch nicht festgestellt.9 AIs sind bei schwangeren Frauen kontraindiziert.
Wechselwirkungen mit anderen Arzneimitteln
Anastrozol hemmt CYP1A2, CYP2C9 und CYP3A4.10,11 Letrozol wird durch CYP2A6 und CYP2C19 metabolisiert, und Exemestan metabolisiert CYP3A4.8,10-13 Induktoren von CYP3A4 wie Rifampicin, Phenytoin, Carbamazepin und Johanniskraut können bei gleichzeitiger Gabe zu einer Abnahme der Exemestanspiegel führen. 8,12,13 Tamoxifen verursacht eine 38% ige Abnahme von Letrozol und eine 27% ige Abnahme von Anastrozol bei gleichzeitiger Anwendung.2,7,8,14
Indikationen und Dosierung
Anastrozol 10,11: Anastrozol 1 mg einmal täglich ist für Brustkrebs im Frühstadium als anfängliche adjuvante Therapie bei postmenopausalen Frauen mit hormonell empfindlicher Erkrankung und als Erstbehandlung bei HR + oder HR-unbekannter metastasierter oder lokal fortgeschrittener Erkrankung indiziert. Es wird auch für Gebrauch nach Tamoxifentherapie in den Frauen mit progressiver Krankheit genehmigt. Bei Nierenfunktionsstörungen oder leichten bis mittelschweren Leberfunktionsstörungen ist keine Dosisanpassung erforderlich.
Letrozol 11,12: Letrozol 2.5 mg einmal täglich ist für postmenopausale Frauen mit HR + Brustkrebs im Frühstadium als Ersttherapie oder als erweiterte adjuvante Therapie nach Tamoxifen indiziert. Es ist auch für HR + oder HR-unbekannte metastasierende Erkrankung angezeigt. Bei schwerer Leberfunktionsstörung werden Dosisanpassungen empfohlen.
Exemestane11,14: Exemestan 25 mg po einmal täglich ist als adjuvante Therapie zwei bis drei Jahre nach Tamoxifen für postmenopausale Frauen mit HR + Brustkrebs im Frühstadium für insgesamt fünf aufeinanderfolgende Jahre Hormontherapie angezeigt. Es kann auch für Krankheiten verwendet werden, die nach der Tamoxifen-Therapie fortgeschritten sind. Es sollte nach einer Mahlzeit eingenommen werden. Bei Leber- oder Nierenfunktionsstörungen ist eine Dosisanpassung nicht erforderlich
Klinische Studien
Tamoxifen-bedingte Toxizitäten wie Endometriumkarzinom veranlassten die Einleitung groß angelegter klinischer Studien zur Untersuchung der Anwendung von AIs der dritten Generation bei postmenopausalen Frauen mit HR + -Brustkrebs. Verschiedene Versuchsdesigns wurden verwendet, um die Leistung dieser Mittel im Vergleich zu Tamoxifen zu bewerten.6 Überlegene Ergebnisse in Bezug auf klinische Wirksamkeit und Toxizitätsprofile etablierten AIs als neuen Standard der adjuvanten Therapie bei postmenopausalen Frauen mit HR + Brustkrebs.6
ATAC15: ATAC (Arimidex, Tamoxifen allein oder in Kombination), eine multizentrische, randomisierte, doppelblinde Studie, verglich drei Behandlungsarme: Tamoxifen 20 mg + Anastrozol Placebo, Anastrozol 1 mg + Tamoxifen Placebo und eine Kombination von Tamoxifen 20 mg + Anastrozol 1 mg. Das primäre Ziel war es, die Sicherheit und Wirksamkeit von Tamoxifen im Vergleich zu Anastrozol und der Kombination von Anastrozol und Tamoxifen über einen Zeitraum von fünf Jahren zu bewerten. Insgesamt 9.366 Patienten – 3.125 im Anastrozol-Arm, 3.116 im Tamoxifen-Arm und 3.125 im Kombinationsarm – wurden über einen Median von 33 Monaten behandelt.
Nach drei Jahren zeigte Anastrozol ein DFS von 89,4% gegenüber 87,4% für Tamoxifen (Hazard Ratio 0,83, 95% CI, P =.013). Anastrozol verringerte die Rate von kontralateralem Brustkrebs (CLBC) im Vergleich zu Tamoxifen (Odds Ratio 0,42, 95% CI, P =.007). Der Kombinationsarm wurde geschlossen, da kein klinischer Nutzen über Tamoxifen hinaus gefunden wurde. Anastrozol war mit Nebenwirkungen wie Endometriumkarzinom (P =.02), vaginale Blutungen, Ausfluss (P <.0001), zerebrovaskuläre Ereignisse (P =.0006), venöse thromboembolische Ereignisse (P =.0006) und Hitzewallungen (P <.0001); Tamoxifen war mit weniger Frakturen und weniger Gelenkschmerzen verbunden (P <.0001). Nach 68 Monaten erhöhte Anastrozol das DFS (HR 0,87, 95% CI , P =.01) und Zeit bis zum Wiederauftreten (HR 0,79, 95%-KI , P =.0005) und verminderte Fernmetastasen (HR 0,86, 95%-KI , P =.04) und CLBC (42% Abnahme, P =.01).16 Nach einem medianen Follow-up-Intervall von 100 Monaten zeigten HR + -Patienten unter Anastrozol Verbesserungen des DFS (HR 0,85; P =.003), Auftreten von CLBC (HR 0,60, P =.004), Zeit bis zum Wiederauftreten (HR 0,76, P =.0001) und Zeit bis zum entfernten Wiederauftreten (HR 0,84, P =.022) verglichen mit Patienten auf Tamoxifen. Der absolute Unterschied in den Rezidivraten verbesserte sich von 2.8% nach fünf Jahren auf 4,8% nach neun Jahren. Die Anastrozol-Frakturraten waren während der Therapie höher, aber der Unterschied nahm nach der 100-monatigen Nachbeobachtungszeit erheblich ab. Die verlängerte Therapiedauer hatte ein Frakturrisiko von 1,15 mit Anastrozol gegenüber 1,02 mit Tamoxifen. Das Risiko für Endometriumkarzinom war auf und neben der Anastrozol-Therapie im Vergleich zu Tamoxifen mit einer jährlichen Rate von 0,043 gegenüber 0,14 bzw. 0,014 gegenüber 0,12 reduziert. Ein Unterschied im Gesamtüberleben (OS) wurde nicht festgestellt.
MA.1712,17: MA.17 war eine randomisierte, placebokontrollierte, doppelblinde Studie zur Beurteilung der Wirksamkeit von fünf Jahren Letrozol-Therapie bei postmenopausalen Frauen mit Brustkrebs, die bereits fünf Jahre adjuvante Tamoxifen-Therapie abgeschlossen hatten. Die Patienten erhielten Letrozol 2,5 mg oder Placebo täglich für fünf Jahre. Der primäre Endpunkt war DFS; sekundäre Endpunkte waren Lebensqualität, erweitertes Sicherheitsprofil und OS. Von den 5.187 Patienten erhielten 2.593 Letrozol und 2.594 Placebo; Die mediane Nachbeobachtungszeit betrug 2,4 Jahre.
In der vorläufigen Analyse gab es 207 lokale oder metastasierte Rezidive von Brustkrebs oder anfänglichen Malignomen von CLBC, 75 in der Letrozol-Gruppe und 132 in der Placebo-Gruppe. Projizierte Vier-Jahres-DFS-ratesÜ für die beiden Gruppen waren 93% und 87%, beziehungsweise (P ?.001 zur Auswertung der DFS). Im Letrozol-Arm hatte das DFS eine HR von 0, 61 (95% CI, P ?.001). Letrozol zeigte eine 43% ige Abnahme der Brustkrebsinzidenz (HR 0,57, 95% CI , P =.00008).4 Mit Ausnahme von knotenpositiven Patienten (P =.04), OS erreichte keine statistische Signifikanz (HR 0,82, P =.30).4 Patienten im Letrozol-Arm hatten niedriggradige vasomotorische Symptome, Myalgie und Arthritis. Osteoporose war häufiger (wenn auch nicht signifikant) im Letrozol-Arm im Vergleich zu Placebo (5,8% vs. 4,5%; P =.07), und die Frakturraten waren zwischen den Armen vergleichbar. Die Studie wurde nach einem Median von 2,4 Jahren wegen einer Abnahme der Brustkrebsereignisse im Letrozol-Arm geschlossen. Erweiterte adjuvante Therapie mit Letrozol nach Abschluss von fünf Jahren Tamoxifen verbesserte DFS.
BIG 1-987,9,18: Die Breast International Group (BIG) 1-98-Studie, eine doppelblinde, multizentrische, randomisierte Studie, umfasste 8.028 postmenopausale Frauen mit HR + Brustkrebs im Frühstadium. Die Studie umfasste vier Behandlungsarme, die fünf Jahre Tamoxifen-Monotherapie, fünf Jahre Letrozol-Monotherapie, Tamoxifen für zwei Jahre, dann einen Wechsel zu Letrozol für drei Jahre, oder Letrozol für zwei Jahre, dann einen Wechsel zu Tamoxifen für drei Jahre. Das Hauptziel war DFS; sekundäre Ziele waren Zeit bis zur Fernmetastasierung, Sicherheit und OS. DFS erhöhte sich bei Patienten, die Letrozol erhielten, im Vergleich zu denen, die Tamoxifen erhielten (HR 0,81, 95% CI, relative Reduktion 19%, P =.003), mit einer absoluten Differenz von 1,5% nach drei Jahren. Tamoxifen erhöhte das Auftreten thromboembolischer Ereignisse im Vergleich zu Letrozol (OR 0,38, P <.0001). Knochenbrüche waren im Letrozol-Arm erhöht (OR 1,44, P =.006).
IES14,19: Die IES (Intergroup Exemestane Study) war eine randomisierte, doppelblinde, multizentrische Phase-III-Studie, deren Ziel es war, festzustellen, ob der Wechsel zu Exemestan nach zwei bis drei Jahren Tamoxifen wirksamer war als die Fortsetzung von Tamoxifen für fünf Jahre. Die Studie umfasste 4.742 postmenopausale Frauen, die in zwei Behandlungsarme randomisiert wurden; 2.362 Probanden sollten nach zwei bis drei Jahren Tamoxifen 20 mg po qd auf Exemestan 25 mg po qd umsteigen, um fünf Jahre Therapie abzuschließen, und die restlichen 2.380 sollten Tamoxifen 20 mg po qd für fünf Jahre erhalten. DFS war der primäre Endpunkt; Sekundäre Endpunkte waren OS, erweitertes Toxizitätsprofil und Häufigkeit von CLBC.
Unerwünschte Ereignisse, die über einen Median von 30,6 Monaten auftraten, umfassten die Häufigkeit von CLBC, lokales oder metastasiertes Wiederauftreten und Tod. Es gab 449 Ereignisse – 183 im Exemestan-Arm und 266 im Tamoxifen-Arm. Der Exemestan-Arm hatte eine unangepasste HR von 0,68 (95% CI, P <.001 durch den Log-Rank-Test), der eine Risikoreduktion von 32% zeigte und analog zu einem Vorteil in DFS von 4 war.75 (95% KI ) nach drei Jahren. Nach drei Jahren hatte der Exemestan-Arm ein DFS von 91,5% (95% CI) im Vergleich zu 86,8% (95% CI) im Tamoxifen-Arm. Es gab keinen signifikanten Unterschied im OS zwischen den beiden Gruppen, mit 93 Todesfällen im Exemestan-Arm und 106 Todesfällen im Tamoxifen-Arm. Es gab einen signifikanten Unterschied in der Häufigkeit von CLBC (P =.04) – 20 Probanden im Tamoxifen-Arm und neun im Exemestan-Arm. Die Verwendung von Exemestan zum Abschluss der fünfjährigen Behandlung nach zwei bis drei Jahren Tamoxifen verbesserte das DFS im Vergleich zu fünf Jahren Tamoxifen.
Verhinderung von Knochenschwund durch AI-Therapie20
Postmenopausale Frauen neigen aufgrund reduzierter Östrogenspiegel zu einer verminderten BMD. Die KI-Therapie bei der postmenopausalen Brustkrebspatientin verschlimmert diese Tendenz. Denosumab, ein vollständig humaner monoklonaler Prüfantikörper, bindet den Rezeptoraktivator für den nuklearen Faktor-kB-Liganden (RANKL) und verhindert die RANKL-Aktivität. RANKL ist lebenswichtig für die osteoklastische Aktivität, also den Knochenabbau. Denosumab und Risedronat, ein Bisphosphonat, werden auf ihre Fähigkeit untersucht, dem mit der AI-Therapie verbundenen Knochenschwund entgegenzuwirken.
Denosumab-Studie20: Eine multizentrische, randomisierte Phase-III-Studie untersuchte die Anwendung von Denosumab 60 mg subkutan einmal alle sechs Monate bei postmenopausalen Frauen, die AIs bei HR + nichtmetastatischem Brustkrebs einnahmen. Ziel war es, die Veränderung der BMD der Lendenwirbelsäule vom Ausgangswert auf 12 Monate zu bewerten. Von den 252 Patienten erhielten 127 Denosumab und 125 Placebo. Beide Arme erhielten Kalzium und Vitamin D. BMD wurde durch Dual-Energy-Röntgenabsorptiometrie bewertet. Nach 12 und 24 Monaten Therapie mit Denosumab oder Placebo gab es einen Unterschied von 5,5% bzw. 7,6% im BMD-Anstieg in der Lendenwirbelsäule zugunsten von Denosumab (P <.0001 für beide Monate). Denosumab zeigte ein vergleichbares Toxizitätsprofil im Vergleich zu Placebo. Die Denosumab-Therapie über einen Zeitraum von mehr als 24 Monaten wurde noch nicht untersucht.
IBIS-II Knochen-Teilstudien21: Die Internationale Brustkrebs-Interventionsstudie-II (IBIS-II) Knochen-Substudie wurde von IBIS-II abgeleitet, die postmenopausale Frauen mit einer erhöhten Wahrscheinlichkeit der Entwicklung von Brustkrebs, die für fünf Jahre zu Anastrozol oder Placebo randomisiert wurden ausgewertet. Die Teilstudie mit einer aktuellen Einschreibung von 700 Patienten untersucht Risedronat im Vergleich zu Placebo zur Prävention von BMD-Verlust bei Frauen mit niedrigen T-Scores zu Studienbeginn. Eine Untergruppe von Patienten aus der IBIS-II-Studie wurde in der Teilstudie einer von drei verschiedenen Behandlungsstrategien zugeordnet. Nach einem Jahr Therapie erhielten 350 Anastrozol- und 350 Placebo-Patienten aus IBIS-II Substudienergebnisse. Stratum 1 umfasste 227 Patienten unter Anastrozol mit normalen T-Scores (T-Score ?1), Stratum 2 umfasste 80 Patienten mit Osteopenie (ñ2.5 ? T-Score <1), die Risedronat 35 mg einmal wöchentlich oder Placebo erhielten, und Stratum 3 umfasste 43 Patienten mit Osteoporose (14 <T-score <2.5), die Risedronat 35 mg einmal wöchentlich erhielten.
Bei Patienten mit Osteopenie oder Osteoporose zu Studienbeginn schien Risedronat den mit Anastrozol verbundenen Knochenverlust zu hemmen. In Stratum II zeigte Risedronat günstige Effekte auf die BMD-Erhaltung für die gesamte Hüfte, nicht jedoch für die Lendenwirbelsäule (P =.005 und P =.15 vs. Placebo). Mit Risedronat waren keine schwerwiegenden Nebenwirkungen oder Wechselwirkungen mit anderen Arzneimitteln verbunden.
Studie mit AIs bei prämenopausalen Frauen (SOFT)21-26
Bei etwa 33% der Frauen unter 50 Jahren wird invasiver Brustkrebs diagnostiziert. 22 Die Suppression of Ovarian Function Trial (SOFT, IBCSG 24-02, BIG 2-02) untersucht den Einsatz der KI-Therapie bei prämenopausalen Frauen mit HR + Brustkrebs. Die Studie, die eine gezielte Patienteneinschreibung von 3.000 hat, umfasst prämenopausale Frauen mit HR + Brustkrebs, die Chemotherapie abgeschlossen haben oder die nur operiert wurden. Ovarialablation wird durch Verabreichung von Triptorelin (ein Gonadotropin-Releasing-Hormon) einmal monatlich für fünf Jahre, chirurgische Oophorektomie oder Beckenbestrahlung etabliert. Der erste Arm erhält Tamoxifen einmal täglich für fünf Jahre, der zweite Arm erhält Tamoxifen für fünf Jahre in Kombination mit Ovarialablation und der dritte Arm erhält Exemestan für fünf Jahre in Kombination mit Ovarialablation. Die Patienten erhalten fünf Jahre lang Exemestan oder Tamoxifen.
Chemoprävention Trials23-27
Tamoxifen ist für Brustkrebs Chemoprävention angezeigt.6 Sein Toxizitätsprofil ist ein Grund für Einschränkungen in Bezug auf die therapeutische Anwendung.6 Das AIs kann die Inzidenz von HR + -Brustkrebs bei Hochrisikopatienten aufgrund einer Abnahme der Inzidenz von CLBC im Vergleich zu Tamoxifen in klinischen Studien wie ATAC verringern.6
AI-Chemopräventionsstudien umfassen die Studie 31-03 der International Breast Cancer Study Group (IBCSG) (IBCSG 31-03) und das MAP des National Cancer Institute of Canada.3 versuch. Das Hauptziel der multizentrischen, internationalen, randomisierten, placebokontrollierten IBCSG 31-03-Studie ist die Bewertung der Anwendung von Anastrozol zur Vorbeugung von Brustkrebs bei postmenopausalen Frauen. Das primäre Endpunktmaß ist die Inzidenz von invasivem und nichtinvasivem Brustkrebs; Das sekundäre Endpunktmaß ist die Inzidenz von Osteoporose und Frakturen.5 Die IBCSG 31-03-Studie hat eine Zielregistrierung von 6,000. anzeigen.3 Studie bewertet Exemestan als chemopräventives Mittel bei postmenopausalen Frauen. Das primäre Ziel der placebokontrollierten KARTE.die Studie soll die Wirksamkeit von Exemestan bei der Verringerung der Inzidenz von invasivem Brustkrebs bewerten.
Mögliche zukünftige Anwendungen: Fallberichte
Letrozol wurde nach dem Versagen von Clomifen verwendet, um die Fruchtbarkeit bei 22 Frauen mit polyzystischem Ovarialsyndrom zu induzieren. Letrozol induzierte den Eisprung in 75% der Zyklen gegenüber 44,4% der durch Clomifen induzierten Zyklen. Vier Schwangerschaften resultierten aus den durch Letrozol induzierten Ovulationen, und mit Letrozol waren keine signifikanten Nebenwirkungen verbunden.28,29
Eine 57-jährige fettleibige Frau mit Endometriose nach Hysterektomie und bilateraler Salpingo-Oophorektomie erhielt Anastrozol nach Megestrol-Therapie. Die Patientin hatte nach neun Monaten keine endometrialen Läsionen.28,30
Ein Patient mit McCune-Albright-Syndrom erhielt Anastrozol zur vorzeitigen Pubertät; Das Östradiol des Patienten normalisierte sich nach 2,5 Jahren Anastrozol und das Knochenalter rückte um sechs Monate vor.28,31 Erhöhtes Östrogen kann Gynäkomastie und hypogonadotropen Hypogonadismus induzieren.28,31 Abnehmendes Östrogen mit einer KI führte zu normalem Gonadotropin und Testosteron bei Männern mit Gynäkomastie und hypogonadotropem Hypogonadismus. 28,31,32
Letrozol wurde bei Patienten mit rezidiviertem Eierstockkrebs untersucht; Diejenigen Patienten, die Letrozol erhielten, hatten eine Stabilisierung der Krankheit.28,33 Neoadjuvantes Letrozol wurde 10 postmenopausalen Frauen mit Endometriumkarzinom verabreicht; das Medikament zeigte konstruktive klinische Veränderungen und hatte keine negativen chirurgischen Auswirkungen.28,34
Wenn die Behandlung mit Testolacton versus Anastrozol bei unfruchtbaren Männern verglichen wurde, war die Wirksamkeit der beiden Mittel ähnlich.28,35 Patienten mit Klinefelter-Syndrom hatten eine wirksamere Behandlung mit Testolacton als mit Anastrozol.28,35
Schlussfolgerungen
Die KIs der dritten Generation haben bei postmenopausalen Frauen mit HR + -Brustkrebs ein überlegenes DFS gezeigt, aber der klinische Nutzen einer mehr als fünfjährigen KI-Therapie bei diesen Patienten wurde nicht nachgewiesen.4 Die National Surgical Adjuvant Breast and Bowel Project (NSABP) B-33 (Exemestan) -Studie und eine anschließende Randomisierung der MA.17 (Letrozol) Studie wird die Verwendung dieser KIs im Vergleich zu Placebo für weitere fünf Jahre untersuchen.4 KIs sind eine geeignete Alternative für HR + postmenopausale Frauen, bei denen Tamoxifen kontraindiziert ist.4
Die vorteilhaften Wirkungen des AIs der dritten Generation umfassen ein tolerierbareres Toxizitätsprofil und ein überlegenes DFS im Vergleich zu Tamoxifen. Das Niveau der Wirksamkeit zwischen diesen Mitteln und Tamoxifen ist vergleichbar. Unsicherheit besteht weiterhin in Bezug auf die ausgewählte Therapiedauer, das Langzeittoxizitätsprofil und die geeignete Verabreichungssequenz für AIs.4 Neue Studien werden benötigt, um selektive aromatase Modulatoren zu produzieren, die weniger Giftigkeit als das AIs produzieren.25,36-37
1. In: Robertson JFR. Fulvestrant (Faslodex ®)–wie man eine gute Droge besser macht. Onkologe . 2007;12:774-784.
2. Osborne CK. Medikamentöse Therapie: Tamoxifen bei der Behandlung von Brustkrebs. In: N Engl J Med. 1998;339:1609-1618.
3. Nationales umfassendes Krebsnetzwerk. NCCN clinical practice guidelines in der Onkologie – v.1.2008. Brustkrebs. www.nccn.org/professionals/physician_gls/f_guidelines.asp . Zugriff Oktober 11, 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. Technologiebewertung der American Society of Clinical Oncology zur Verwendung von Aromatasehemmern als adjuvante Therapie bei postmenopausalen Frauen mit Hormonrezeptorpositivem Brustkrebs: Statusbericht 2004. In: J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Prävention von hormonbedingten Krebserkrankungen: Brustkrebs. In: J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. Aromatasehemmer bei Brustkrebs. In: N Engl J Med. 2003;348:2431-2442.
7. Gossmann, Strasser K. Aromatasehemmer bei der Behandlung und Vorbeugung von Brustkrebs. In: J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al., Hrsg. In: Drug Information Handbook. 13. Aufl. Hudson, OH: Lexi-Comp; 2005:117.598.871.
9. Ellis MJ, Hrsg. Aromatasehemmer zur Behandlung von Brustkrebs. Manhasset, NY: Onkologie-Verlagsgruppe, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (Anastrozol) Packungsbeilage. Wilmington, DE: AstraZeneca Pharmaceuticals LP; Mai 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&show=Abteilung&Artikel-ID=9884. Zugriff am 17.März 2008.
14. Aromasin (Exemestan) Packungsbeilage. New York, New York: Pfizer Inc; Februar 2007.
15. Baum M, Budzar AU, Cuzick J, et al, für die ATAC Trialists‘ Group. Anastrozol allein oder in Kombination mit Tamoxifen versus Tamoxifen allein zur adjuvanten Behandlung von postmenopausalen Frauen mit Brustkrebs im Frühstadium: erste Ergebnisse der randomisierten ATAC-Studie. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, für die ATAC Trialists‘ Group. Ergebnisse der ATAC-Studie (Arimidex, Tamoxifen, allein oder in Kombination) nach Abschluss der 5-jährigen adjuvanten Behandlung von Brustkrebs. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. Eine randomisierte Studie mit Letrozol bei postmenopausalen Frauen nach fünf Jahren Tamoxifen-Therapie bei Brustkrebs im Frühstadium. In: N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS, et al, für die Breast International Group (BIG) 1-98 Kollaborative Gruppe. Ein Vergleich von Letrozol und Tamoxifen bei postmenopausalen Frauen mit Brustkrebs im Frühstadium. In: N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, für die Intergruppen-Exemestan-Studie. Eine randomisierte Studie mit Exemestan nach zwei bis drei Jahren Tamoxifentherapie bei postmenopausalen Frauen mit primärem Brustkrebs. In: N Engl J Med. 2004;350:
1081-1092.
20. Ellis G, Knochen HG, Chlebowski R, et al. Eine Phase-3-Studie zur Wirkung der Denosumab-Therapie auf die Knochenmineraldichte bei Frauen, die Aromatasehemmer für nicht metastasierten Brustkrebs erhalten. Vortrag auf: dem 30. jährlichen San Antonio Breast Cancer Symposium; Dezember 13-16, 2007; San Antonio, TX. Zusammenfassung 47.
21. Die Ergebnisse der Studie wurden von Singh S., Cuzick J., Edwards R., et al. Wirkung von Anastrozol auf die Knochenmineraldichte nach einjähriger Behandlung: Ergebnisse aus der Knochen-Teilstudie der International Breast Cancer Intervention Study (IBIS-II). Paper präsentiert auf: das 30. jährliche San Antonio Breast Cancer Symposium; Dezember 13-16, 2007; San Antonio, TX. Zusammenfassung 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. Adjuvante endokrine Therapie für prämenopausale Frauen mit Brustkrebs im Frühstadium. In: J Clin Oncol. 2005;23:1736-1750.
23. Nationales Krebsinstitut. Brustkrebsbehandlung (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional . Zugriff Dezember 26, 2007.
24. Baylor College of Medicine Klinische Studien. Unterdrückung der Ovarialfunktion Studie (WEICH). www.breastcenter.tmc.edu/clinic/trials/soft.htm . Zugriff Dezember 26, 2007.
25. Aebi S, Castiglione-Gertsch M. Adjuvante endokrine Therapie für sehr junge Patienten. Brust. 2003;12:509-515.
26. ClinicalTrials.gov . Unterdrückung der Eierstockfunktion plus Tamoxifen oder Exemestan im Vergleich zu Tamoxifen allein bei der Behandlung von prämenopausalen Frauen mit hormonell ansprechendem Brustkrebs. www.clinicaltrials.gov /. Zugriff Dezember 26, 2007.
27. Cuzick J. Aromatase-Hemmer für die Prävention von Brustkrebs. In: J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, OruÁ S, Koyuncu FM. Aromatasehemmer: mögliche zukünftige Anwendungen. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Verwendung eines Aromatasehemmers zur Induktion des Eisprungs bei Patienten mit unzureichender Reaktion auf Clomiphencitrat. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Rolle der Aromatase bei Endometriumerkrankungen. In: J Steroid Biochem Mol Biol. 2001;79:19-25.
31. In: Feuillan P, Merke D, Leschek EW, Cutler GB. Verwendung von Aromatasehemmern in der vorzeitigen Pubertät. Endocr Relat Krebs. 1999;6:303-306.
32. Schreiber M, Sebastian S, Takayama K, et al. Östrogenüberschuss im Zusammenhang mit neuartigen Gain-of-Function-Mutationen, die das Aromatase-Gen beeinflussen. In: N Engl J Med. 2003;348:1855-1865.
33. Die Ergebnisse wurden in folgenden Studien veröffentlicht: Bowman A, Gabra H, Langdon SP, et al. Die CA 125-Reaktion ist mit der Expression von Östrogenrezeptoren in einer Phase-II-Studie mit Letrozol bei Eierstockkrebs assoziiert: identifizierung einer endokrinempfindlichen Untergruppe. Clin Cancer Res. 2002;8:2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Neoadjuvante Therapie von Endometriumkarzinom mit dem Aromatasehemmer Letrozol: endokrine und klinische Wirkungen. In: Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Aromatasehemmer für männliche Unfruchtbarkeit. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatase und seine Inhibitoren: Bedeutung für die Brustkrebstherapie. Aktuelle Prog Horm Res. 2002;57:317-338.