Einleitung
Fossile Ressourcen sind der wichtigste Rohstoff für Energie und organische Verbindungen, und ihre Verwendung führt zur Emission von Treibhausgasen im Zusammenhang mit dem Klimawandel. Der bevorstehende Klimacrash erfordert einen dringenden Übergang von einer fossilen zu einer biobasierten Wirtschaft, in der lignozellulosehaltige Biomasse anstelle von Öl zur Herstellung von Brennstoffen, Chemikalien und Materialien verwendet wird. Holz ist eine wichtige Quelle für lignozellulosehaltige Biomasse; es besteht hauptsächlich aus sekundär verdickten Zellwänden, die reich an Cellulose, Hemicellulosen und Lignin sind. Alle drei Polymere können in der biobasierten Wirtschaft verwertet werden. Cellulose ist eine Quelle für die Zellstoff- und Papierindustrie, und sowohl Cellulose als auch Hemicellulosen können zu ihren Monosacchariden zur Fermentation in z. B. Bioethanol, Milchsäure und Detergenzien depolymerisiert werden (Vanholme et al., 2013b). Da Lignin die Effizienz der Holzverarbeitung für diese Anwendungen negativ beeinflusst, können Bäume so konstruiert werden, dass sie weniger Lignin ansammeln, um für die Herstellung von Papier und fermentierbarem Zucker zugänglicher zu werden. Andererseits wird Lignin zunehmend als wertvoller Bestandteil der biobasierten Wirtschaft angesehen. Angesichts der Tatsache, dass Lignin die größte erneuerbare Aromaquelle der Erde ist, kann die Wirtschaftlichkeit einer Bioraffinerie erheblich gesteigert werden, wenn Lignin ebenfalls bewertet und als Ressource für die Herstellung von Chemikalien verwendet wird (Holladay et al., 2007; Tuck et al., 2012; In: Davis et al., 2013; Ragauskas et al., 2014; Li C. et al., 2015; Van den Bosch et al., 2015; Rinaldi et al., 2016; Upton und Kasko, 2016; Schutyser et al., 2018).
Das Ligninpolymer besteht aus Monolignolen, die auf den Biosynthesewegen Phenylpropanoid und Monolignol durch eine Reihe von enzymatischen Reaktionen hergestellt werden, beginnend mit der Desaminierung von Phenylalanin (Abbildung 1). Die Monolignole werden im Zytoplasma synthetisiert und zum Apoplasten transloziert, wo sie durch Einwirkung von Laccasen und Peroxidasen zu Monolignolradikalen dehydriert werden (Berthet et al., 2011; Zhao et al., 2013). Diese Monolignolradikale koppeln dann kombinatorisch miteinander und erzeugen eine Reihe chemischer Bindungen wie die Aryletherbindung (β-O-4), die Resinolbindung (β-β) und die Phenylcumaranbindung (β-5) (Boerjan et al., 2003; Ralph et al., 2004; Vanholme et al., 2010). Die gebräuchlichsten Monolignole sind die Hydroxycinnamylalkohole p-Cumaryl-, Coniferyl- und Sinapylalkohole, die beim Einbau in das Ligninpolymer die H-, G- und S-Einheiten erzeugen (Bonawitz und Chapple, 2010; Ralph et al., 2019; Vanholme et al., 2019). Der relative Beitrag der Ligninbausteine variiert je nach Taxa, Entwicklungsstadium, Gewebe- und Zelltyp und sogar Zellwandschicht; Lignin aus Weichhölzern (Gymnospermen) besteht fast ausschließlich aus G-Einheiten mit einem geringen Anteil an H-Einheiten, während Lignin aus Harthölzern (Angiospermen) zusätzlich zu G-Einheiten und Spuren von H-Einheiten S-Einheiten aufweist (Boerjan et al., 2003; Vanholme et al., 2010, 2019). Neben diesen traditionellen Monolignolen können eine Vielzahl anderer p-hydroxylierter aromatischer Moleküle in unterschiedlichem Maße in das Ligninpolymer eingebaut werden (Vanholme et al., 2019).
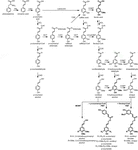
Figure 1. Lignin biosynthetic pathway. Alternative monomers and heterologously expressed enzymes are shown in bold. PAL, phenylalanine ammonia-lyase; C4H, cinnamate 4-hydroxylase; 4CL, 4-coumarate:CoA ligase; HCT, p-Hydroxycinnamoyl-CoA:quinate/shikimate-p-hydroxycinnamoyltransferase; C3’H, p-coumaroyl quinate/shikimate 3’-hydroxylase; CSE, caffeoyl shikimate esterase; CCoAOMT, caffeoyl-CoA O-methyltransferase; CCR, cinnamoyl-CoA reductase; F5H, ferulate 5-hydroxylase/CAld5H, coniferaldehyde 5-hydroxylase; COMT, Kaffeesäure-O-Methyltransferase; CAD, Zimtalkoholdehydrogenase; FMT, Feruloyl-CoA-Monolignoltransferase; PMT, p-Cumaroyl-CoA-Monolignoltransferase.
Angesichts der Tatsache, dass Lignin ein wichtiger widerspenstiger Faktor bei Holzdelignifizierungsprozessen ist, wurden große Forschungsanstrengungen unternommen, um den Ligninbiosyntheseweg zu entschlüsseln und die Auswirkungen von Störungen der Ligninbiosynthesegene auf die Ligninmenge und -zusammensetzung sowie auf die Holzverarbeitungseffizienz zu untersuchen. Während Modifikationen in Genen, die von Transkriptionsfaktoren bis zu oxidativen Enzymen reichen, zu einem veränderten Ligningehalt, einer veränderten Zusammensetzung oder Ablagerung geführt haben (Eriksson et al., 2000; Li Y.H. et al., 2003; Liang et al., 2008; Lu et al., 2013; Lin et al., 2016; J.S. H. et al., 2017; Yang et al., 2017; Obudulu et al., 2018) wird sich diese Überprüfung auf die Ergebnisse konzentrieren, die durch das Engineering der ligninbiosynthetischen Gene erzielt wurden.
Entwicklung des Ligninweges
Tabelle 1 gibt einen Überblick über die verschiedenen Studien zu herunterregulierten oder mutierten ligninbiosynthetischen Genen in Pappel, Kiefer, Eukalyptus und Birke mit den daraus resultierenden Auswirkungen auf die Holzverarbeitungseffizienz, wenn sie bestimmt werden. Eine Verringerung der Aktivität eines beliebigen Schrittes des Ligninbiosynthesewegs, beginnend mit PAL bis CAD, kann zu einer Verringerung des Ligningehalts führen (Tabelle 1). Mehrere Parameter beeinflussen den Grad der Ligninreduktion, wie das Zielgen und der Grad der Herunterregulierung der Enzymaktivität, was wiederum von der Effizienz des verwendeten Silencing-Konstrukts, der Größe der Genfamilie und der Redundanz innerhalb der Genfamilie abhängt. Im Allgemeinen führt die Herunterregulierung der Schritte von C4H bis CCR zu einer drastischeren Verringerung der Ligninmenge (Hu et al., 1999; Meyermans et al., 2000; Zhong et al., 2000; Li L. et al., 2003; Jia et al., 2004; Lu et al., 2004; Leplé et al., 2007; Coleman et al., 2008a,b; Bjurhager et al., 2010; Mansfield et al., 2012; Ralph et al., 2012; Min et al., 2014; Van Acker et al., 2014; Zhou et al., 2015, 2018; Saleme et al., 2017; Xiang et al., 2017) als Herunterregulierung von F5H, COMT und CAD (Van Doorsselaere et al., 1995; Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Van Acker et al., 2014; Wang et al., 2018). Die Ligninreduktion kann mit einem Anstieg von S / G verbunden sein, wie z. B. in C3’H- (Coleman et al., 2008a; Ralph et al., 2012) und CCoAOMT-herunterregulierte Bäume (Meyermans et al., 2000) oder eine Abnahme des S/G-Verhältnisses wie bei CSE- (Saleme et al., 2017) und COMT-herunterregulierte Bäume (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000). Interessanterweise wurde bei ligninarmen 4CL-herunterregulierten Pappeln ein Anstieg von S / G festgestellt (Min et al., 2014; Xiang et al., 2017), eine Abnahme von S/G (Voelker et al., 2010; Zhou et al., 2015) oder Verhältnissen vergleichbar mit Wildtyp (Hu et al., 1999; Li L. et al., 2003). Diese Varianz kann nicht mit dem Promotor oder der Methode zur Herunterregulierung in Verbindung gebracht werden, was darauf hindeutet, dass Unterschiede im Grad der Stummschaltung, Wachstumsbedingungen oder Entwicklungszustand dieses Merkmal beeinflussen. Andererseits wurden die stärksten Auswirkungen auf die H / G / S-Ligninzusammensetzung bei Bäumen beobachtet, die in C3’H und HCT herunterreguliert sind und Lignin mit einem starken Anstieg des H-Einheitengehalts ablagern (Coleman et al., 2008a; Ralph et al., 2012; Vanholme et al., 2013a), während Bäume, die F5H überexprimieren, stark an S-Einheiten angereichertes Lignin produzieren (Franke et al., 2000; Li L. et al., 2003; Stewart et al., 2009), und Bäume, die in COMT herunterreguliert werden, haben die Biosynthese von S-Einheiten dramatisch reduziert (Van Doorsselaere et al., 1995; Lapierre et al., 1999).

Tabelle 1. Überblick über Waldbäume mit modifizierter Expression von Ligninbiosynthese-Genen.
Die Verarbeitungseffizienz der Biomasse kann auch durch den verstärkten Einbau von Molekülen verändert werden, die im Allgemeinen kleinere Komponenten im Lignin von Wildtyp-Pflanzen darstellen. Der Einbau von Ferulasäure in CCR-defiziente Bäume führt zur Bildung von Acetalbindungen im Ligninpolymer, die in sauren Biomassevorbehandlungen leicht gespalten werden können (Leplé et al., 2007; Ralph et al., 2008; Van Acker et al., 2014). Tatsächlich korrelierten die Gehalte an Ferulasäure in Lignin positiv mit einer höheren Verzuckungseffizienz (Van Acker et al., 2014). Der Einbau von 5-Hydroxyconiferylalkohol und 5-Hydroxyconiferaldehyd in das Lignin von COMT-defizienten Pappeln (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000; Morreel et al., 2004; Lu et al., 2010) führt zu Benzodioxanbindungen, die möglicherweise kovalente Verknüpfungen zwischen Lignin und den Polysaccharidhydroxylgruppen verhindern (Weng et al., 2010; Vanholme et al., 2012; Nishimura et al., 2018). Andererseits führt ein COMT-Mangel auch zu einem stärker kondensierten Lignin aufgrund der relativ höheren Spiegel der kondensierten β-β- und β-5-Bindungen und der niedrigeren Spiegel der β-O-4-Bindungen, wenn die Frequenz der S-Einheit abfällt. Das chemische Aufschließen von Holz aus Pappeln, das für COMT stark herunterreguliert wurde, führte zu einer höheren Zellstoffausbeute, die durch den Restligningehalt im Zellstoff ausgeglichen wurde. Diese Bäume hatten einen niedrigeren Lignin- und einen höheren Cellulosegehalt (Jouanin et al., 2000). Auf der anderen Seite wiesen Pappeln, die für COMT moderat herunterreguliert wurden, einen starken Rückgang der Zellstoffausbeute auf, vermutlich weil der Ligningehalt normal geblieben war, während das Lignin eine höhere Häufigkeit kondensierter Bindungen aufwies, die die Ligninextraktion negativ beeinflussten (Lapierre et al., 1999; Pilatus et al., 2002). Der Einbau von Zimtaldehyden in das Ligninpolymer in CAD-defizienten Bäumen führt zu kürzeren Ligninpolymerketten, daher zu einem höheren Anteil an freien phenolischen Endgruppen, die die Löslichkeit des Polymers in Alkali erhöhen. Der Einbau von Zimtaldehyden in das Ligninpolymer reduziert vermutlich auch die kovalente Wechselwirkung der aliphatischen Kette mit Hemicellulose, wodurch das Lignin wieder löslicher wird. Darüber hinaus wird aufgrund des erweiterten konjugierten Systems, das erzeugt wird, wenn ein Zimtaldehyd β-O-4 mit einem anderen Monomer koppelt, die aromatische Etherbindung des eingebauten Zimtaldehyds anfälliger für alkalische Spaltung (Lapierre et al., 1989; Van Acker et al., 2017).
Die Ligninpolymerisation ist ein kombinatorischer radikalischer Kopplungsprozess, der es ermöglicht, eine Vielzahl von phenolischen Verbindungen auf natürliche Weise in das Ligninpolymer einzubauen (Boerjan et al., 2003; Vanholme et al., 2019). Forscher haben versucht, die Ligninmenge und -zusammensetzung anzupassen, um die Biomasseverarbeitung durch Expression heterologer Gene zu verbessern, mit dem Ziel der Biosynthese und des Einbaus verschiedener kompatibler phenolischer Verbindungen als alternative Monolignole in das Ligninpolymer (Ralph, 2006; Vanholme et al., 2012; Mottiar et al., 2016; Mahon und Mansfield, 2018). Ein Beispiel ist die Einführung von Genen, die Enzyme kodieren, die für die Biosynthese von S-Einheiten in Kiefern benötigt werden; Die gleichzeitige Expression von F5H, COMT und CAD führte erfolgreich S-Einheiten in Pinus radiata ein (Wagner et al., 2015; Edmunds et al., 2017). Die Einführung des Gens, das für eine Monolignol-4-O-Methyltransferase (MOMT4) kodiert, in Pappel führt zur Bildung von 4-O-methylierten Koniferyl- und Sinapylalkoholen, die nicht in das wachsende Ligninpolymer eingebaut werden können, da ihnen die aromatische Hydroxylgruppe fehlt. Dies führt zu einem Stopp der Ligninpolymerisation und führt zu Bäumen mit niedrigerem Ligningehalt und höherer Verzuckungseffizienz (Bhuiya und Liu, 2010; Cai et al., 2016). Pappeln wurden auch so konstruiert, dass sie Esterbindungen im Ligninpolymer-Rückgrat enthalten. Coniferylferulat-Ester wurden über die Expression eines FERULOYL-CoA:MONOLIGNOL-TRANSFERASE (FMT)-Gens aus Angelica sinensis in das Polymer eingeführt (Wilkerson et al., 2014), was zu einer verbesserten Verzuckerungseffizienz unter verschiedenen Vorbehandlungsbedingungen führt (Wilkerson et al., 2014; Kim et al., 2017; Bhalla et al., 2018) und eine verbesserte Kraft-Aufschluss-Effizienz im Vergleich zum Wildtyp (Zhou et al., 2017). Monolignol-p-Cumaratester wurden auch in Pappel durch Expression eines Reis-p-CUMAROYL-CoA: MONOLIGNOL-TRANSFERASE (PMT) -Gens hergestellt, was zu einer höheren Häufigkeit resistenter Interunit-Bindungen und einer höheren Häufigkeit von G- und S-terminalen Einheiten mit freien phenolischen Gruppen führte (Smith et al., 2015; Sibout et al., 2016). Während in Arabidopsis die heterologe Expression von PMT zu einer reduzierten Ligninmenge bei gleichzeitig erhöhter Verzuckerungseffizienz führte (Sibout et al., 2016) gab es keine Abnahme der Ligninmenge in Pappel und die Verzuckerungseffizienz wurde nicht bestimmt (Smith et al., 2015).
Während mehrere Modifikationen der Ligninmenge und -zusammensetzung gezeigt haben, dass sie Verbesserungen bei der Biomasseverarbeitung bewirken, gingen diese Modifikationen häufig mit einer Verringerung der Biomasseausbeute einher (Leplé et al., 2007; Wadenbäck et al., 2008; Wagner et al., 2009; Voelker et al., 2010; Stout et al., 2014; Van Acker et al., 2014; Sykes et al., 2015; Zhou et al., 2018). Eine kürzlich durchgeführte Metastudie störte 21 Ligninbiosynthesegene in P. trichocarpa und integrierte umfassend die Ergebnisse transkriptomischer, proteomischer, fluxomischer und phänomenischer Daten von 221 Linien. Die Autoren folgerten, dass das Baumwachstum nicht mit der Ligninmenge, der Zusammensetzung der Untereinheit oder spezifischen Verknüpfungen verbunden ist (Wang et al., 2018), sondern korrelierte eher mit dem Vorhandensein kollabierter Xylemgefäße (Coleman et al., 2008a,b; Wagner et al., 2009; Voelker et al., 2010; Vargas et al., 2016; De Meester et al., 2018), die Aktivierung eines Zellwandintegritätswegs (Bonawitz et al., 2014) und/oder die Akkumulation chemischer Inhibitoren (Gallego-Giraldo et al., 2011; Muro-Villanueva et al., 2019).
Während erhebliche Anstrengungen unternommen wurden, den Ligningehalt durch Herunterregulierung von ligninbiosynthetischen Genen zu verringern, waren Studien zur Hochregulierung des Ligninwegs und zur Überproduktion von Lignin rar. Tatsächlich zeigen Berichte über die Überexpression von F5H eine unveränderte oder sogar eine Abnahme des Ligningehalts (Huntley et al., 2003; Li L. et al., 2003; Stewart et al., 2009; Mansfield et al., 2012; Edmunds et al., 2017). Die Überexpression von CAD und COMT hat eher zu einer Gen-Stummschaltung als zu einer Hochregulation geführt, oder es wurde kein Effekt auf die Expressionsniveaus festgestellt (Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Leplé et al., 2007; Van Acker et al., 2014). Die Überexpression der R2R3-MYB-Transkriptionsfaktoren PtoMYB92, PtoMYB216 und PtoMYB74 führte zu zusätzlichen Xylemschichten, dickeren Xylemzellwänden sowie ektopischer Ligninablagerung, und die Pflanzen akkumulierten 13-50% mehr Lignin (Tian Q. et al., 2013; Li C.F. et al., 2015; Li et al., 2018). Die MYB-Überexpressionslinien regulierten konstitutiv die Gene des Ligninbiosynthesewegs, und während Pflanzen, die MYB92 und MYB74 überexprimierten, eine Biomassestrafe aufwiesen, führte die Überexpression von MYB216 zu Pflanzen mit bis zu 50% mehr Lignin und keinem Entwicklungsphänotyp. Da Lignin zunehmend als wichtige Ressource für die nachhaltige Produktion von Chemikalien angesehen wird (Cao et al., 2018) Das Engineering von Anlagen, die Lignin überproduzieren, sollte weiter erforscht werden.
Feldversuche
Die oben diskutierten Beispiele zeigen deutlich, dass Ligninengineering über Down- oder Upregulation von Phenylpropanoid–Signalweggenen – oder Expression heterologer Gene – das Potenzial hat, die Verarbeitungseffizienz von lignozellulosehaltiger Biomasse zu erhöhen. Aus praktischen und regulatorischen Gründen berichten die meisten Studien über Daten, die aus der Analyse von Bäumen stammen, die in einem Gewächshaus angebaut wurden. Experimente mit Bäumen, die in einem Gewächshaus gezüchtet wurden, berücksichtigen jedoch normalerweise keine Entwicklungsprozesse wie Wachstumsstopp und Ruhe. Darüber hinaus liefern Gewächshausexperimente keinen ausreichenden Einblick in die Interaktion der technischen Pflanze mit Umweltfaktoren wie Bodentyp, Wind und Krankheitserregern. Das Verständnis dieser Wechselwirkungen ist ein wichtiger Schritt bei der Übersetzung von Forschungsergebnissen in kommerzielle Anwendungen. In der Tat, Die Arbeit, die durch Studien, für die die Erlaubnis zur Durchführung von Feldversuchen erteilt wurde, hervorgebracht wurde, hebt wichtige Unterschiede im Phänotyp zwischen Gewächshaus- und Freilandbäumen hervor. Tabelle 1 fasst die Berichte über Feldversuche zusammen, die mit herunterregulierten 4CL-, CCoAOMT-, CCR-, COMT- und CAD-Bäumen durchgeführt wurden.
Als Bestätigung des Potenzials modifizierter lignozellulosehaltiger Biomasse als Substrat für Anwendungen zeigten mehrere Lignin-engineered field-trial grown Trees Verbesserungen in der Holzverarbeitung. Pappeln, die 5 Jahre lang in einem Feldversuch in Peking (China) für CCoAOMT herunterreguliert wurden, zeigten eine erhöhte Glucose- und Xylose-Freisetzung bei Verzuckerung (Wang et al., 2012). Pappeln, die für CCR herunterreguliert und in einem Feldversuch in Frankreich gezüchtet wurden, erwiesen sich als zugänglicher für chemische Kraftaufschlussmittel (Leplé et al., 2007). Zwei weitere Feldversuche in Frankreich und Belgien mit CCR-herunterregulierten Pappeln führten zu einer Verbesserung der Ethanolproduktion um bis zu 160% bei gleichzeitiger Verzuckerung und Fermentation (SSF); Die Pflanzen hatten jedoch eine Biomassereduktion von bis zu 50% (Van Acker et al., 2014). Feldversuche mit CAD-herunterregulierter Pappel zeigten ebenfalls vielversprechende Ergebnisse. Diese Bäume zeigten etwas weniger Lignin als Wildtyp und erwiesen sich als zugänglicher für die Kraft-Delignifizierung (Lapierre et al., 1999). Konsistent zeigten die gleichen Linien, die in größeren Feldversuchen in Frankreich und dem Vereinigten Königreich gezüchtet wurden, eine leichte Abnahme der Ligninmenge und eine Verbesserung der Kraftstoffauflösung, die als kommerziell relevant erachtet wurde, da die Pflanzen 6% weniger Alkali benötigten, um eine Delignifizierung ähnlich der von Wildtyp-Bäumen zu erreichen (Pilate et al., 2002).Widersprüchliche Berichte über Biomasseertrag und Effizienz der nachgelagerten Verarbeitung deuten jedoch darauf hin, dass diese Parameter stark von Umweltfaktoren beeinflusst werden. Während ein in China durchgeführter Feldversuch mit herunterregulierten 4CL-Pappeln ergab, dass die Bäume trotz einer Abnahme des Ligningehalts um 28% im Vergleich zum Wildtyp eine um etwa 8% erhöhte Höhe aufwiesen (Tian X.M. et al., 2013), im Einklang mit Gewächshausstudien (Hu et al., 1999), andere Feldversuche fanden heraus, dass 4CL-herunterregulierte Pappeln die Biomasse verringert hatten und manchmal sogar in den Schatten gestellt wurden (Voelker et al., 2010; Stout et al., 2014; Marchin et al., 2017). Die Berichte gehen auch hinsichtlich der nachgelagerten Verarbeitungseffizienz von Holz aus diesen 4CL-herunterregulierten Feldpappeln auseinander. Während bei 4CL1-herunterregulierten Bäumen (35S-gesteuertes Antisense-4CL-Konstrukt), die an einem Bergstandort in den USA angebaut wurden, eine Steigerung der Zuckerrückgewinnung um bis zu 100% festgestellt wurde (Xiang et al., 2017), Daten aus Feldstudien, die in Oregon (USA) durchgeführt wurden, ergaben, dass Pt4CL1-promotorgesteuerte Antisense-Silenced-4CL1-Pappeln im Vergleich zum Wildtyp keine Verbesserung der Verzuckerungseffizienz aufwiesen (Voelker et al., 2010). Ebenso ergab eine Langzeitstudie in Wenling (China), dass 4CL-herunterregulierte Pappeln im Vergleich zum Wildtyp keine signifikante Verbesserung des Zuckerertrags zeigten (Wang et al., 2012). In beiden letzteren Fällen zeigten die Bäume eine leichte Abnahme der Ligninmenge, die sich nicht in einer höheren Verarbeitungseffizienz niederschlug, möglicherweise aufgrund der höheren Konzentration von Extraktstoffen, die die enzymatische Aktivität beeinträchtigen könnten (Voelker et al., 2010).
Feldstudien haben gezeigt, dass Umweltfaktoren die Verholzung beeinflussen und die Merkmale auf Wildtypniveau wiederherstellen können, verglichen mit den Werten, die erreicht wurden, als die gleichen Pflanzen im Gewächshaus gezüchtet wurden. Während 4CL-herunterregulierte Bäume einen verringerten Ligningehalt aufwiesen, wenn sie unter Gewächshausbedingungen gezüchtet wurden, hat die Analyse der gleichen 4CL-Antisense-Pappeln, die jedoch auf dem Feld angebaut wurden, oft gezeigt, dass der Ligningehalt im Vergleich zu den im Gewächshaus gewachsenen Bäumen erhöht und manchmal sogar auf Wildtyp-Niveau wiederhergestellt wurde (Stout et al., 2014; Xiang et al., 2017). In ähnlicher Weise waren die Ligninwerte bei CCR-defizienten Pappeln beim Anbau auf dem Feld viel weniger reduziert als beim Anbau im Gewächshaus (Van Acker et al., 2014). Zumindest für die CCR-defizienten Pappeln ist es möglich, dass der höhere Verholzungsgrad der Feldgehölze darauf zurückzuführen ist, dass die Holzproben im Winter entnommen wurden. Wenn das Baumwachstum im Herbst aufhört, haben die Bäume noch Zeit, ihre Zellwände vollständig zu verholzen, wenn der Baum in die Ruhephase eintritt, im Vergleich zu im Gewächshaus gewachsenen Bäumen, die kontinuierlich neues Xylem entwickeln. Es wurde auch gezeigt, dass sich die Ligninzusammensetzung zwischen Gewächshaus- und Freilandbäumen mit niedrigem Ligningehalt unterscheidet. 4CL-herunterregulierte Pappeln, die auf einem Feld in North Carolina gezüchtet wurden, hatten Lignin mit einem niedrigeren S / G als wenn die gleichen Linien im Gewächshaus gezüchtet wurden (Stout et al., 2014).
zusammengenommen zeigen diese Ergebnisse, dass Daten, die von im Gewächshaus gewachsenen Bäumen gewonnen wurden, nicht einfach auf Freilandbäume extrapoliert werden können, was die Notwendigkeit von Feldversuchen an verschiedenen Standorten untermauert. Einige Linien wiesen eine Ertragsstrafe auf, die sie für Anwendungen weniger interessant machte, was die Notwendigkeit eines besseren Verständnisses der molekularen Grundlage der Ertragsstrafe und der Entwicklung von Strategien zur Überwindung dieses Problems hervorhob.
Es wurde gezeigt, dass Lignin eine wichtige Rolle bei der Resistenz von Krankheitserregern spielt (Miedes et al., 2014; Zhao und Dixon, 2014), und es spielt eine entscheidende Rolle, wenn es der Anlage erlaubt, Wasser zu transportieren. Dies deutet darauf hin, dass Ligninmodifikationen einen Einfluss auf die Stresstoleranz der Pflanzen haben könnten. Während weitere Untersuchungen erforderlich sind, um diese Möglichkeit vollständig zu berücksichtigen, hat die Herunterregulierung von 4CL, COMT und CAD in Pappeln die Fütterungsleistung von blattfressenden Pflanzenfressern nicht dramatisch verändert (Tiimonen et al., 2005; Brodeur-Campbell et al., 2006; Hjalten et al., 2013). Die Wirkung der Herunterregulierung von COMT und CAD in Pappeln auf Pflanzen-Insekten-Interaktionen wurde auch an Freilandbäumen untersucht, und es wurde gezeigt, dass die ligninmodifizierten Bäume eine normale Inzidenz von Besuchen und Fütterungen von Insekten sowie normale Reaktionen auf mikrobielle Krankheitserreger aufwiesen (Pilate et al., 2002; Halpin et al., 2007). Diese Ergebnisse zeigen, dass Bäume mit modifiziertem Lignin nicht unbedingt mehr als Wildtyp-Pflanzen von Schädlingen und Krankheiten leiden. Dennoch zeigte die Profilierung des bakteriellen Mikrobioms der Endosphäre von Holz, das aus feldgewachsenen, CCR-herunterregulierten Pappeln geerntet wurde, Verschiebungen in der Bakteriengemeinschaft, vermutlich aufgrund der veränderten Häufigkeit bestimmter phenolischer Metaboliten im Xylem (Beckers et al., 2017).
In Anbetracht der Rolle von Lignin in der Xylemfunktion und -struktur wurden die Wasserverhältnisse einiger weniger ligninmodifizierter Pappeln bewertet. Es wurde festgestellt, dass 4CL-herunterregulierte Pappeln eine reduzierte hydraulische Leitfähigkeit aufweisen, die möglicherweise das Pflanzenwachstum beeinträchtigt (Marchin et al., 2017). Hydraulische Belastungsexperimente mit Pappeln, die für CCR, COMT oder CAD herunterreguliert wurden, zeigten, dass diese Pflanzen einen geringeren Widerstand gegen Kavitation aufwiesen, während sie die normale hydraulische Leitfähigkeit und den Wassertransport von Xylem beibehielten (Awad et al., 2012). Diese Ergebnisse legen nahe, dass das Wachstum von ligninarmen Mutanten durch die Verfügbarkeit von Wasser beeinflusst werden könnte. Wie bei jeder neuen Hybride, die aus der klassischen Züchtung gewonnen wird, sind Feldversuche erforderlich, um die Feldleistung und Stresstoleranz von Lignin-Bäumen zu bewerten.
Aussichten für Lignin-Engineering in Waldbäumen
Die Leistung von Lignin-Engineering-Anlagen scheint stark von den Umweltbedingungen beeinflusst zu werden. Es ist jedoch unklar, ob die beobachteten Unterschiede zwischen Gewächshaus- und Freilandbäumen oder zwischen Bäumen, die an verschiedenen Feldstandorten angebaut werden, auf unterschiedliche Ebenen der Gensuppression oder auf die Interaktion des technischen Merkmals mit der Umwelt (GxE) zurückzuführen sind. In der Tat ist eine instabile Herunterregulierung ein Mangel an Gen-Silencing-Techniken, die auf RNAi basieren. Dies wird durch die Beobachtung einer Variation des roten Xylem-Phänotyps beobachtet, die beobachtet wird, wenn bestimmte Ligninbiosynthesegene wie CAD, COMT oder CCR herunterreguliert werden. Die rote Xylemfärbung ist oft nicht im gesamten Xylem einheitlich, sondern tritt in Flecken auf, die variable Ebenen der Genstummschaltung widerspiegeln (Leplé et al., 2007; Voelker et al., 2010; Van Acker et al., 2014; Abbildung 2). Darüber hinaus kann die Verwendung von Gen–Silencing–Methoden möglicherweise dazu führen, dass eng verwandte Genfamilienmitglieder – möglicherweise in unterschiedlichem Maße – gleichzeitig zum Schweigen gebracht werden, was die Interpretationen trübt und die Auswirkungen der Herunterregulierung einzelner Gene verschleiert.

Abbildung 2. Patchy Gen-Downregulation durch RNAi. Fleckiger roter Xylem-Phänotyp, beobachtet an Stämmen von CCR-defizienten Pappeln (rechts), die in einem Feldversuch in Belgien gezüchtet wurden. Das rote Xylem zeigt Bereiche der CCR-Herunterregulierung an. Holz von Wildtyp-Bäumen ist weißlich (links).
Diese Probleme können nun leicht durch den Einsatz von CRISPR-basierten Gen-Editing-Technologien überwunden werden, die stabile Funktionsverlustmutationen (Knock-outs) in bestimmten Zielgenen ermöglichen und die Dissektion der Funktion einzelner Gene innerhalb von Familien ermöglichen. Beispielsweise zeigte das Targeting einzelner Mitglieder der 4CL-Genfamilie in Pappeln, dass 4CL1 mit der Verholzung zusammenhängt, während 4CL2 an der Proanthocyanidinproduktion beteiligt ist (Zhou et al., 2015). Zusätzlich zu Knock-out-Allelen ermöglicht die CRISPR-basierte Genbearbeitung auch die Erzeugung neuer Allele, die eine teilweise Verringerung der Enzymaktivität bewirken. Dies eröffnet die Möglichkeit, das Niveau der Restenzymaktivität fein abzustimmen und die Ausbeuteeinbuße zu umgehen, die häufig beobachtet wird, wenn die Ligninmenge unter einen Schwellenwert fällt. Ein weiterer vielversprechender Weg für das Lignin-Engineering in Waldbäumen, der durch CRISPR-basiertes Genom-Engineering ermöglicht wird, ist die gleichzeitige Bearbeitung mehrerer Gene (Allel-Stacking), um die Effizienz der Biomasseverarbeitung zu optimieren, wie in Arabidopsis gezeigt, wo das Stapeln der Transaldolase (tra) – und comt-Mutationen, der c4h- und comt-Mutationen oder der 4cl- und comt-Mutationen zu additiven und synergistischen Verbesserungen der Verzuckerungseffizienz führte (de Vries et al., 2018). Tatsächlich, ein Systemansatz in P. trichocarpa prognostiziert, dass die gleichzeitige Herunterregulierung von PAL und CCoAOMT oder PAL, C3’H und CCOAOMT die Holzeigenschaften und die Zuckerfreisetzung erheblich verbessern wird (Wang et al., 2018).
Der Einsatz von CRISPR-basiertem Genome Editing bei der Baumverbesserung für die Zellstoff- und Papierindustrie und die Bioraffinerie sowie für die Herstellung von Plattformaromaten aus dem hydrogenolytischen Abbau von Lignin wird am wertvollsten sein, wenn diese Technologie strategisch mit anderen Züchtungstechniken kombiniert wird (Abbildung 3). Tatsächlich gibt es bereits große Unterschiede in der Ligninmenge und der S / G-Zusammensetzung in natürlichen Populationen von Waldbäumen (Studer et al., 2011). Da beide Merkmale die Glukosefreisetzung bei der Verzuckerung beeinflussen (Yoo et al., 2018), Nutzung dieser genetischen Vielfalt durch konventionelle Züchtung, unterstützt durch genomweite Assoziationsstudien (GWAS) (Porth et al., 2013; Fahrenkrog et al., 2017; Liu et al., 2018), Züchtung mit seltenen defekten Allelen (BRDA) (Vanholme et al., 2013a) oder genomische Selektion (Yin et al., 2010; Muchero et al., 2015; Pawar et al., 2018; Xie et al., 2018), ist eine wertvolle Strategie, um Linien zu erhalten, die die Effizienz der Holzverarbeitung verbessert haben. Sobald Elitebäume durch diese Züchtungsmethoden gewonnen werden, ist Gentechnik und CRISPR-basierte Genbearbeitung spezifischer Gene ein vielversprechender Weg, um diese Elite-Genotypen weiter zu verbessern, ohne ihre genetische Konstitution aufzubrechen und ohne lange Zuchtzyklen zu durchlaufen. Angesichts des bevorstehenden Klimacrashs haben wir keine Zeit mehr zu verlieren, wenn wir diese neuen Züchtungstechniken in unserem Wettlauf um die biobasierte Wirtschaft anwenden.
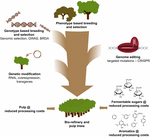
Abbildung 3. Genetische Verbesserung von Waldbäumen durch eine Kombination von Zuchtwerkzeugen. Um die genetische Verbesserung von Waldbäumen für Zellstoff- und Bioraffinerieanwendungen zu beschleunigen, müssen klassische und neue Züchtungswerkzeuge intelligent kombiniert werden. Die klassische Züchtung beinhaltet die phänotypische Selektion von Bäumen für kontrollierte Kreuzungen, gefolgt von der phänotypischen Selektion. Mit dem Aufkommen der Genomsequenzinformationen vieler Waldbäume wurden neue Strategien wie genomische Selektion, genomweite Assoziationsstudien (GWAS) und Züchtung mit seltenen defekten Allelen (BRDA) entwickelt, um die Erfassung und Anreicherung von DNA-Polymorphismen, die mit vorteilhaften Merkmalen assoziiert sind, zu beschleunigen. CRISPR-basierte Genombearbeitung ermöglicht es, das Genom so zu modifizieren, dass natürliche Polymorphismen nachgeahmt werden. Genetische Veränderung beinhaltet die stabile Integration von Fremd-DNA in den Baum, um (ein) Enzym (e) zu überproduzieren oder (ein) Gen (e) herunterzuregulieren. Die Kombination der klassischen und neuen Züchtungstechniken ist erforderlich, um ausreichend hochwertiges Holz für die Gesellschaft bereitzustellen.
Autorenbeiträge
Alle aufgeführten Autoren haben einen wesentlichen, direkten und intellektuellen Beitrag zum Werk geleistet und es zur Veröffentlichung freigegeben.
Finanzierung
Wir erkennen eine Teilfinanzierung durch das IWT-SBO-Projekt BIOLEUM (Grant No. 130039) und durch SBO-FISH durch das ARBOREF-Projekt an. AC wurde von der FWO und dem Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Marie Skłodowska-Curie-Fördervereinbarung Nr. 665501 gefördert. LdV wurde vom Institut für Innovationsförderung durch Wissenschaft und Technologie in Flandern (IWT-Vlaanderen) für ein Predoctoral Fellowship finanziert.
Erklärung zum Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Annick Bleys für die Vorbereitung dieses Manuskripts zur Einreichung.
Boerjan, W., Ralph, J. und Baucher, M. (2003). Lignin-Biosynthese. Jahr. In: Plant Biol. 54, 519–546.
PubMed Abstract / Google Scholar
Lapierre, C., Pollet, B., Petit-Conil, M., Toval, G., Romero, J., Pilatus, G., et al. (1999). Strukturelle Veränderungen von Ligninen in transgenen Pappeln mit verminderter Cinnamylalkoholdehydrogenase- oder Kaffeesäure-O-Methyltransferase-Aktivität haben einen gegenteiligen Einfluss auf die Effizienz des industriellen Kraftaufschlusses. In: Plant Physiol. 119, 153–163.
PubMed Abstract / Google Scholar
Ralph, J. (2006). „Was macht einen guten Monolignol-Ersatz aus?,“ in der Wissenschaft und Überlieferung der Pflanzenzellwand – Biosynthese, Struktur und Funktion, Hrsg. T. Hayashi (Boca Raton, FL: BrownWalker Press).
Google Scholar