Was ist das Redoxpotential einer Zelle?
Lesemodus
Redoxpotentiale werden verwendet, um die freien Energiekosten und die Richtung von Reaktionen mit Elektronentransfer zu charakterisieren, einer der allgegenwärtigsten und wichtigsten biochemischen Reaktionen. Solche Reduktions-Oxidationsreaktionen sind durch eine Änderung der freien Energie gekennzeichnet, die einige konzeptionelle Merkmale mit denen teilt, die zur Beschreibung von pKa in Säure-Base-Reaktionen verwendet werden, bei denen der Protonentransfer eher beteiligt ist als der Elektronentransfer. In dieser Vignette, einer der abstraktesten im Buch, diskutieren wir, wie das Redoxpotential als Maß für die treibende Kraft für eine bestimmte Oxidations-Reduktions-Reaktion von Interesse verwendet werden kann. Im Gegensatz zum pH-Wert macht es keinen Sinn, einer ganzen Zelle ein einzelnes Redoxpotential zuzuordnen.
Das Redoxpotential oder genauer das Reduktionspotential einer Verbindung bezieht sich auf ihre Tendenz, Elektronen zu erwerben und dadurch reduziert zu werden. Einige Leser erinnern sich vielleicht an das mnemonische „ÖL“, das uns daran erinnert, dass „Oxidation Verlust, Reduktion Gewinn ist“, wobei Verlust und Gewinn von Elektronen sind. Betrachten Sie eine Reaktion, die einen Elektronentransfer beinhaltet: Aox + ne– ↔ Ared wobei n Elektronen von der oxidierten Form (Aox) aufgenommen werden, um die reduzierte Form (Ared) der Verbindung A zu erhalten. Die Redoxpotentialdifferenz ΔE zwischen Elektronendonor und Akzeptor hängt mit der damit verbundenen freien Energieänderung ΔG der Reaktion über ΔG = nFΔE zusammen, wobei n die Anzahl der übertragenen Elektronen und F die Faradaysche Konstante (96.485 J / mol / V oder ≈100 kJ / mol / V) ist. Durch die Untersuchung tabellarischer Werte dieser Potentiale ist es möglich, eine Intuition für die Tendenz zum Elektronentransfer und damit für die Richtung der Reaktion zu entwickeln.

Abbildung 1: Ein „Redoxturm“, der das Redoxpotential gängiger metabolischer Halbreaktionen zeigt. Stoffwechselprozesse können als bewegte Elektronen zwischen Molekülen gesehen werden, wobei oft ein Teil der Energie eingefangen wird, die freigesetzt wird, wenn sich die Elektronen von hochenergetischen zu niedrigeren Energiezuständen wie Glykolyse oder Atmung bewegen. Elektronen, die von den „Halbreaktionen“ oben gespendet werden, können in einer Halbreaktion unten am Turm verbraucht werden, um eine thermodynamisch günstige Reaktion abzuschließen. Zum Beispiel beinhaltet der Nettoprozess der Glykolyse die Oxidation von Glucose zu Pyruvat, gekoppelt mit der Reduktion von NAD + zu NADH. Da die Oxidation von Glucose oben im Turm liegt und die Reduktion von NAD + darunter liegt, ist dieser Elektronenfluss thermodynamisch günstig. Im Vergleich zur ATP-Hydrolyseskala können wir auch sehen, dass dieser Elektronenfluss günstig genug ist, um ATP zu erzeugen. Die aerobe Atmung beinhaltet viele Zwischenelektronentransfers durch die Elektronentransportkette. Mehrere dieser Übergänge werden gezeigt, einschließlich der Oxidation von Succinat zu Fumarat, die mechanistisch mit der Reduktion von Ubichinon zu Ubiquinol in den inneren mitochrondrialen Membranen gekoppelt ist. Jeder dieser Zwischenelektronentransfers muss für sich genommen thermodynamisch günstig sein, damit die Atmung ablaufen kann. Durch den Vergleich mit der „ATP-Hydrolyseskala“ können wir sehen, dass die einzelnen Transformationen in der Elektronentransportkette nicht energisch genug sind, um ATP alleine zu erzeugen. Sie sind jedoch günstig genug, um ein Proton über die Zelle oder die Mitochondrienmembran zu pumpen. Dies ist die energetische Grundlage für die Chemiosmose: Zellen speichern Energiequanten, die für die ATP-Synthese zu klein sind, im Protonengradienten über eine Membran. Diese Energie wird später zur Erzeugung von ATP verwendet, indem der H + -Gradient durch die ATP-Synthase in Phosphoanhydridbindungen auf ATP umgewandelt wird.
Obwohl oft behauptet wird, ATP sei die Energiewährung der Zelle, sind für das energetische Gleichgewicht der Zelle die Träger der reduzierenden Kraft selbst nicht weniger wichtig. Das wichtigste Beispiel für diese Träger ist das Molekül NADH in seiner reduzierten oder oxidierten (NAD+) Form. Wir können das Redoxpotential nutzen, um diese beiden molekularen Protagonisten zu verbinden und eine Obergrenze für die Anzahl der ATP-Moleküle abzuschätzen, die aus der Oxidation von NADH (beispielsweise im TCA-Zyklus) hergestellt werden können. Das NAD + / NADH-Paar hat ein Redoxpotential von E = -0,32 V und wird durch Sauerstoff zu Wasser (Protonen aus den Medien) mit einem Redoxpotential von E = + 0,82 V oxidiert. Beide sind in Abbildung 1 als Teil eines „Redoxturms“ wichtiger biologischer Halbreaktionen dargestellt, die verknüpft werden können, um die gesamte Redoxpotentialänderung und damit die freie Energie zu ermitteln. Für die oben betrachtete Reaktion der NADH-Oxidation durch Sauerstoff beträgt die maximal zugehörige freie Energie, die extrahiert werden kann, somit
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x(0,82-(-0,32)) V = 230 kJ/mol≈ 90 kBT,
wobei n=2 und F≈100kJ/mol/V. Da die ATP-Hydrolyse eine freie Energieänderung von ≈50kJ/mol unter unter physiologischen Bedingungen stellen wir fest, dass 228 kJ / mol ausreichen, um ein Maximum von 228/50≈4,5 ATPs zu erzeugen. In der Zelle durchläuft die Oxidation von NADH mehrere Atmungsschritte und führt zum Transfer von 10 Protonen über die Membran gegen das elektrochemische Potential (BNID 101773). Diese Protonentransfers entsprechen einer weiteren Möglichkeit, biochemische Energie einzufangen. Diese Energie wird dann von der ATPase verwendet, um 2-3 ATPs zu erzeugen. Wir finden also, dass etwa die Hälfte der Energie, die bei der Übertragung von Elektronen von NADH zu Sauerstoff freigesetzt wurde, in ATP konserviert ist. Um sicherzustellen, dass die Reaktion gerichtet abläuft, um ATP zu produzieren, anstatt es zu verbrauchen, muss ein Teil der Energie „verschwendet“ werden, da das System aus dem Gleichgewicht geraten muss.
Warum sollte man Redoxpotentiale von Halbreaktionen und nicht freie Energien von Vollreaktionen diskutieren? Die Geräte selbst verdanken ihren Ursprung der Fähigkeit auf dem Gebiet der Elektrochemie, im Labor die Spannungsdifferenz, d. H. Das in Volt gemessene Potential, über zwei Kammern, die unterschiedliche Elektronenträger enthalten, zu messen und die Netzreaktion mit einer Spannung zu stoppen. Die Nützlichkeit von Redoxpotentialen für Halbreaktionen liegt in der Fähigkeit, Kombinationen verschiedener Donoren und Akzeptoren zusammenzustellen, um die thermodynamische Durchführbarkeit und den Energiegewinn jeder betrachteten Reaktion zu bewerten. Wenn Sie k mögliche Elektronentransferverbindungen haben, können die ~ k2 möglichen Reaktionen nur basierend auf den k Redoxpotentialen vorhergesagt werden.
So wie wir vom pH-Wert einer Lösung sprechen, könnten wir uns auf den ersten Blick vorstellen, dass es möglich wäre, von einem scheinbar analogen Redoxpotential der Zelle zu sprechen. Die Kenntnis der Konzentration der reduzierten und oxidierten Formen eines gegebenen Reaktionspaares definiert ihr gesamtes Redoxpotential über die Beziehung
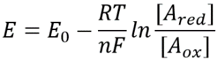
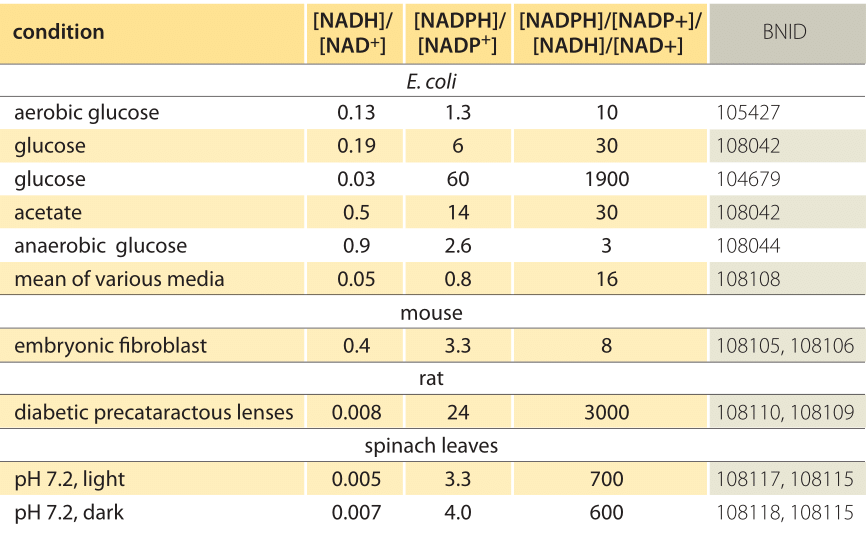
Tabelle 1: Konzentrationsverhältnisse der gemeinsamen Elektronendonorpaare NAD/NADH und NADP/NADPH. Wie zu sehen ist, ist das erste relativ oxidiert und das zweite relativ reduziert, wobei das Verhältnis zwischen ihnen normalerweise viel größer als 1 ist.
Diese Gleichung (eine sogenannte Nernst-Gleichung) liefert den Wert des Redoxpotentials unter zelltypischen Konzentrationsbedingungen im Gegensatz zu den Standardzustandsbedingungen (wobei per Definition =). Betrachten Sie als Beispiel die Spende eines Elektrons an NAD +, was zu der oxidierten Form NADH führt. In der mitochondrialen Matrix wird ein Verhältnis von 10-fach mehr der oxidierten Form angegeben (BNID 100779), wie in Tabelle 1 gezeigt. In diesem Fall beträgt der Faktor ≈30 mV und somit ändert sich das Redoxpotential von -0,32 V auf -0,29 V. Um sicherzugehen, dass die Richtung der Wirkung, die wir erhalten haben, vernünftig ist, bemerken wir, dass mit einem Überfluss der oxidierten Form die Tendenz, durch Sauerstoff oxidiert zu werden, etwas geringer ist, wie durch die Tatsache gesehen, dass das Redoxpotential jetzt näher als zuvor an dem des Sauerstoff / Wasser-Elektronenaustauschers liegt Paar (+0,82 V).
Eine Zelle befindet sich nicht im Gleichgewicht und es besteht eine schwache Kopplung zwischen verschiedenen Redoxpaaren. Diese Situation führt zur Etablierung unterschiedlicher Redoxpotentiale für koexistierende Redoxpaare in der Zelle. Wenn die Flüsse der Produktion und Nutzung der reduzierten und oxidierten Formen eines Redoxpaares, Ared und Aox und eines anderen Bred und Box, viel größer sind als ihr Interkonversionsfluss, Ared+Box<>Aox+Bred , dann können A und B sehr unterschiedliche Redoxpotentiale haben. Infolgedessen ist es schlecht definiert, nach dem gesamten Redoxpotential der Zelle zu fragen, da es für verschiedene Komponenten innerhalb der Zelle unterschiedlich ist. Im Gegensatz dazu ist der pH-Wert der Zelle (oder eines Kompartiments darin) viel besser definiert, da Wasser als universelles Medium dient, das die verschiedenen Säure-Base-Reaktionen koppelt und das sogenannte chemische Potenzial aller Spezies ausgleicht.
Für ein gegebenes Redoxpaar in einem gegebenen Zellkompartiment gibt das Konzentrationsverhältnis der beiden Formen das Redoxpotential in wohldefinierter Weise vor. Verbindungen, die Elektronen schnell austauschen, befinden sich im relativen Gleichgewicht und teilen sich daher ein ähnliches Redoxpotential. Um zu sehen, wie sich diese Ideen auswirken, ist es daher am nützlichsten, ein Redoxpaar in Betracht zu ziehen, das an vielen wichtigen zellulären Reaktionen beteiligt ist und daher eng mit dem Redoxzustand vieler Verbindungen zusammenhängt. Glutathion im Zytoplasma ist eine solche Verbindung, da es an der Reduktion und Oxidation der in Cysteinaminosäuren vieler Proteine weit verbreiteten Thiolbindungen (solche, die Schwefel enthalten) beteiligt ist. Glutathion ist ein Tripeptid (bestehend aus 3 Aminosäuren), das zentrale ein Cystein, das in reduzierter (GSH) oder oxidierter Form vorliegen kann, wobei es mit einem Cystein aus einem anderen Glutathionmolekül (bezeichnet als GSSG) ein Dimer bildet. Die Halbreaktion für Glutathion ist somit 2 x GSH <> GSSG + 2e– + 2H+. Die andere Halbreaktion ist oft eine Schwefelbindung, die in einem rezeptiven Protein „geöffnet“ wird und somit aufgrund der konstanten Wirkung von Glutathion in der reduzierten Form gehalten wird. Glutathion ist auch ein dominierender Akteur bei der Neutralisierung reaktiver Verbindungen, die eine hohe Tendenz haben, Elektronen zu schnappen und somit andere Moleküle zu oxidieren. Solche Verbindungen werden unter oxidativem Stress hergestellt, beispielsweise wenn die Kapazität der Elektronentransferreaktionen der Atmung oder Photosynthese erreicht ist. Kollektiv genannt ROS (reaktive Sauerstoffspezies) Sie können Chaos in der Zelle verursachen und sind an vielen Alterungsprozessen beteiligt. Die doppelte Rolle von Glutathion bei der Aufrechterhaltung der ordnungsgemäßen Faltung von Proteinen und der Begrenzung von ROS sowie seine relativ hohe Konzentration und Elektronentransferreaktivität machen es zum Hauptvertreter für den Redoxzustand der Zelle. Die Konzentration von Glutathion in der Zelle beträgt ≈ 10 Mm (BNID 104679, 104704, 111464) und ist damit der zweithäufigste Metabolit in der Zelle (nach Glutamat), wodurch sichergestellt wird, dass es eine dominierende Rolle als Elektronendonor bei der Redoxkontrolle der Proteinfunktion spielt. In anderen Funktionen von Zellen gibt es andere dominante Elektronenpaare. Bei biosynthetischen anabolen Reaktionen ist das NADP + / NADPH-Paar und bei abbaukatabolischen Reaktionen NAD + / NADH.
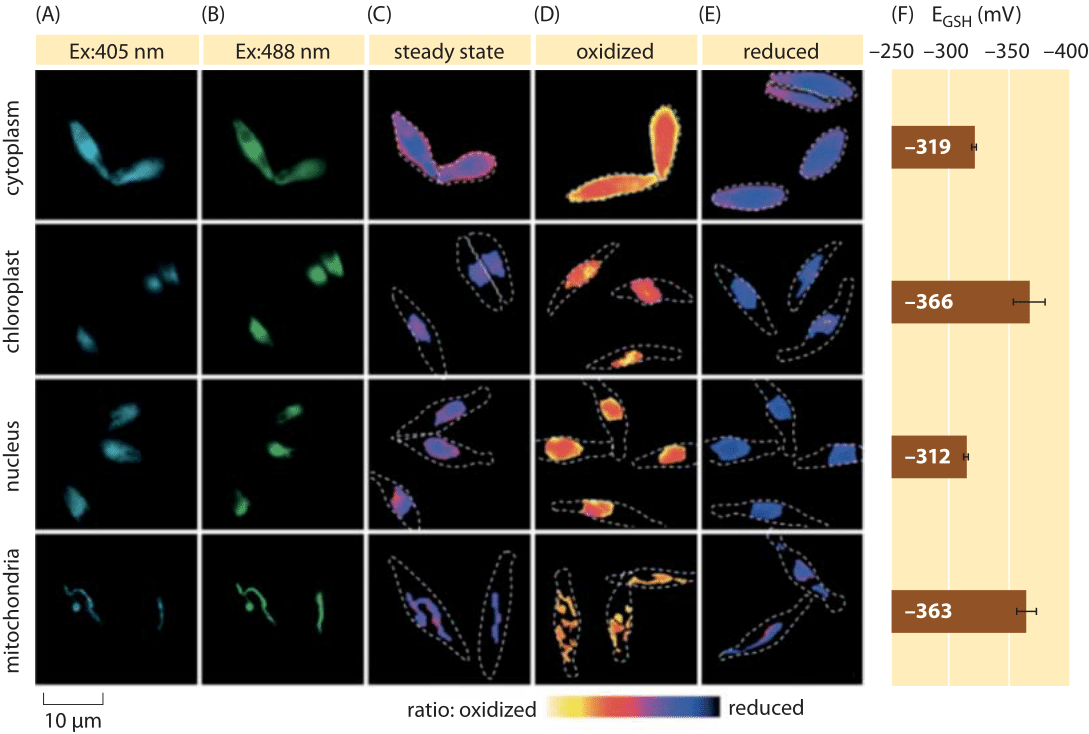
Abbildung 2: Bildgebung des subzellulären Redoxpotentials des Glutathionpools in Kieselalgen in vivo. Fluoreszenzmikroskopische Bildgebung von P. tricornutum-Zellen, die roGFP2 in verschiedenen subzellulären Lokalisationen exprimieren. Fluoreszenzbilder bei zwei Anregungswellenlängen (A, B) wurden geteilt, um ratiometrische Werte (C) zu erhalten. Zur Kalibrierung werden ratiometrische Bilder unter stark oxidativen (150 mM H2O2) (D) und reduktiven (1 mM DTT) (E) Bedingungen aufgenommen. Gestrichelte Linien stellen den Umriss der Zellen dar, der basierend auf den Hellfeldbildern gezeichnet wird. (F) Das Steady-State-Redoxpotential des Glutathionpools, EGSH in mV, wurde basierend auf der Nernst-Gleichung unter Verwendung des Oxidationsniveaus unter gegebenen pH-Werten für jede Organelle berechnet. Adaptiert von: S. Graff van Creveld et al., ISME J., 9:385, 2015.
Wie misst man Redoxpotentiale in lebenden Zellen? Ein weiterer Nutznießer der Fluoreszenzproteinrevolution war das Thema Redoxpotentiale. Ein Reporter-GFP wurde durch Einbau von Cysteinaminosäuren, die die Fluoreszenz aufgrund ihrer Reduktion durch den Glutathionpool beeinflussen, redoxempfindlich konstruiert. Abbildung 2 zeigt das Ergebnis der Verwendung eines solchen Reporters, um das Glutathion-Redoxpotential in verschiedenen Kompartimenten einer Kieselalge zu untersuchen.
Aus Messungen des Redoxzustands des Glutathionpools in verschiedenen Zellorganellen und unter unterschiedlichen Bedingungen können wir auf das Konzentrationsverhältnis der reduzierten zu oxidierten Formen schließen. Die Werte reichen von etwa -170 mV in der ER und in apoptotischen Zellen bis etwa -300 mV in den meisten anderen Organellen und in Proliferationszellen (BNID 103543, 101823, 111456, 111465). Da das Standard-Redoxpotential von Glutathion -240 mV beträgt (BNID 111453, 111463), wie hoch ist dann das Verhältnis von reduziertem zu oxidiertem Glutathion? Unter Verwendung der Nernst-Gleichung (oder äquivalent aus der Boltzmann-Verteilung) entspricht eine zehnfache Änderung des Verhältnisses Produkt / Reaktant einer Erhöhung der freien Energie um ≈6 kJ / mol (≈2 kBT). Angesichts der 2 Elektronen, die in der GSH / GSSG-Reaktion übertragen werden, ist diese Änderung des Konzentrationsverhältnisses normalerweise gleich 30mV, obwohl für Glutathion die Stöchiometrie von 2 GSH-Molekülen, die zu einem kovalent gebundenen GSSG-Molekül verschmelzen, dies nur eine Annäherung darstellt. Die 100-mV-Änderung, die unter verschiedenen Bedingungen gemeldet wurde, spiegelt ein Konzentrationsverhältnis zwischen etwa gleichen Mengen der reduzierten und oxidierten Form (in apoptotischen Zellen) zu einer über 1.000-fach höheren Konzentration der reduzierten Form wider. Tatsächlich ist die oxidierte Form unter den meisten zellulären Bedingungen nur ein sehr kleiner Bruchteil des Gesamtpools, hat aber immer noch physiologische Auswirkungen.
Ein verwirrender Aspekt von Redoxreaktionen ist, dass der Transfer verschiedene Formen annehmen kann. In einem Fall sind es nur Elektronen wie bei den Reaktionen, die von Cytochromen in Elektronentransferketten durchgeführt werden. In einem anderen häufigen Fall ist es eine Kombination von Elektronen und Protonen wie im Cofaktor NAD + / NADH, wo zwei Elektronen und ein Proton (H +) übertragen werden. Schließlich gibt es die Reaktionen, bei denen die gleiche Anzahl von Elektronen und Protonen übertragen wird, wenn man natürlich versucht wäre, die Übertragung von Wasserstoff zu diskutieren. Dies ist beispielsweise bei der Gesamtreaktion der Glucoseoxidation der Fall, bei der Sauerstoff zu Wasser reduziert wird. Zwei Wasserstoffatome wurden also übertragen, sollte man also über den Transfer von Elektronen, Wasserstoffatomen oder Protonen sprechen? Die Definition des Redoxpotentials (oben angegeben) konzentriert sich nur auf den „Zustand“ des Elektrons. Was ist mit den Protonen und was passiert mit diesen, wenn man auf eine Kette von Elektronentransferreaktionen stößt, bei denen einige Zwischenverbindungen die Wasserstoffprotonen enthalten und andere nicht? Die Erklärung liegt im umgebenden Wasser und ihrem pH-Wert. Die Reaktion findet bei einem bestimmten pH-Wert statt, und die reagierenden Verbindungen befinden sich im Gleichgewicht mit diesem pH-Wert. Die Abgabe oder Aufnahme eines Protons hat daher keinen Einfluss auf die Energetik. Das wässrige Medium dient als Pool, in dem Protonen „geparkt“ werden können, wenn die Transferreaktion ausschließlich aus Elektronen besteht (die Analogie stammt aus dem sehr zugänglichen Einführungsbuch zur Biochemie „The chemistry of life“ von Steven Rose). Diese geparkten Protonen können in nachfolgenden Stadien zurückgeliehen werden, wie es im Endstadium der oxidativen Atmung der Fall ist, wo Cytochromoxidase Protonen aus dem Medium entnimmt. Da man davon ausgeht, dass Wasser allgegenwärtig ist, muss man Protonen nicht berücksichtigen, außer wenn man den vorherrschenden pH-Wert kennt, der die Tendenz darstellt, Protonen zu geben oder zu empfangen. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




