Nun, betrachten Sie die Delokalisierung der Elektronendichte. Das heißt, wenn die Elektronendichte so weit wie möglich in einem Molekül verteilt ist, so dass der minimale Ladungsaufbau in einem gegebenen Orbital vorhanden ist.
Das wird beschrieben:
- kollektiv von allen Resonanzmitwirkenden in Lewis-Strukturen.
- kollektiv durch alle einzelnen Molekülorbitalbeiträge in Molekülorbitaldiagrammen.
(Es gibt feine Unterschiede zwischen diesen, aber diese sind der Einfachheit halber ungefähr analog. Sehen Sie hier für weitere Details.)
Die Lokalisierung der Elektronendichte ist das Fehlen davon.
Es ist, wenn wir die gesamte Elektronendichte in ein paar Orbitale stopfen, anstatt sie auszubreiten, und es passiert fast nie wirklich in einem echten Molekül oder Quantensystem (auch wenn keine Resonanz stattfindet).
BEISPIEL MIT RESONANZSTRUKTUREN
Betrachten Sie das isolierte (nicht reagierende) Allylkation, #“C“_3″H“_5^(+)#.
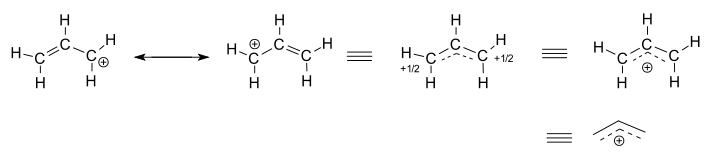
- Die linken beiden Strukturen sind Resonanzmitwirkende, von denen jede lokalisierte Darstellungen der wahren delokalisierten Struktur sind.
- Die drei rechten Strukturen sind jeweils Repräsentationen der Resonanzhybridstruktur bzw. der delokalisierten Struktur.
Die delokalisierte Struktur wird grundsätzlich durch eine Ansammlung von Bindungsorbitalen beschrieben.
BEISPIEL MIT EINEM MOLEKÜLORBITALDIAGRAMM
Betrachten Sie das Allylkation erneut in einem MO-Diagramm, das NUR die #bbpi # -Elektronen beschreibt (dh die Elektronen, die sich in einer #pi # -Bindung in einer lokalisierten Doppelbindung befinden würden!), erlaubt aber die Teilnahme an Reaktionen:
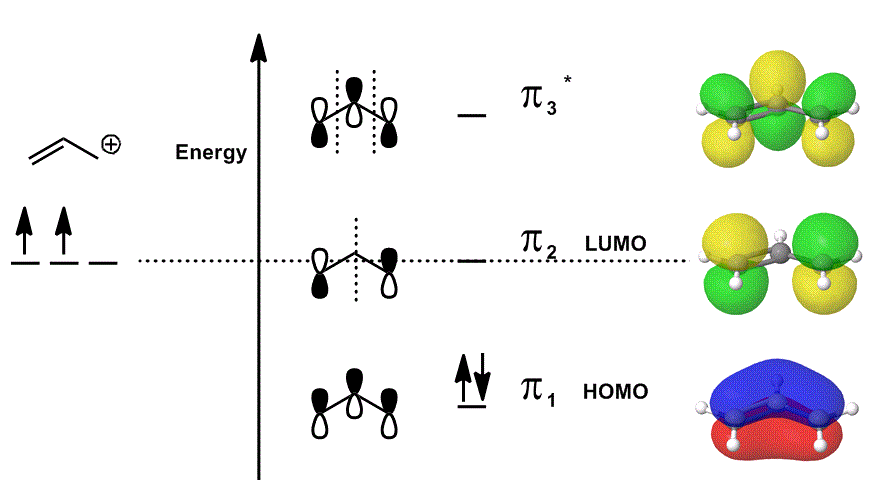
- Jeder der Orbitalbeiträge in der Mitte ist lokalisiert dargestellt; die Atomorbitale, die sich überlappen würden, sind als sie selbst dargestellt (Phase eingeschlossen).
- Jedes der Orbitale ganz rechts (eines pro Zeile) ist delokalisiert dargestellt; die Elektronendichte kann sich ausbreiten, so dass die Molekülorbitale unter vollständiger Berücksichtigung von Überlappungen, Knoten und Phasen dargestellt werden.
Wenn Sie #pi_1#, #pi_2# und #pi_3^“*“# überlappen und den gewichteten Beitrag dieser Zustände (gewichtet nach den Koeffizienten #c_i#) einbeziehen, erhalten Sie die lineare Kombination von Molekülorbitalen:
#Psi_(„allyl“^(+)) = c_1overbrace(pi_1)^“bonding“ + c_2overbrace(pi_2)^“nonbonding“ + c_3overbrace(pi_3^“*“)^“antibonding“#
and #Psi_(„allyl“^(+))# then describes the overall verteilung von Zuständen, die kollektiv die Reaktivität des Allylkations beschreiben.
Mit anderen Worten, #pi_1# (das #pi # Elektronen zur Bindung spendet), #pi_2# (das Elektronen zur Bindung akzeptiert) und #pi_3 ^“*“# (in diesem Fall wird es selten teilnehmen) tun alle etwas, wenn das Allylkation an einer chemischen Reaktion teilnimmt, weil (wenn besetzt) sie gleichzeitig existieren.