Ein guter Ausgangspunkt, um die Elektronenkonfiguration eines Ions zu finden, ist die Elektronenkonfiguration des neutralen Atoms.
In Ihrem Fall müssen Sie die Elektronenkonfiguration des Fluoridanions finden, #“F“^(-)#, also beginnen Sie mit dem Schreiben der Elektronenkonfiguration eines neutralen Fluoratoms, #“F“#.
Fluor befindet sich in Periode 2, Gruppe 17 des Periodensystems und hat eine Ordnungszahl von #9#. Dies sagt Ihnen, dass das neutrale Fluoratom insgesamt # 9 # Elektronen hat, die seinen Kern umgeben.
Seine Elektronenkonfiguration wird sein
#“F: “ 1s^2 2s^2 2p^5#
Nun wird das #“F“ ^(-)# Anion gebildet, wenn #1# Elektron zu einem neutralen Fluoratom hinzugefügt wird.
Beachten Sie, dass die 2p-Unterschale des neutralen Atoms #5# Elektronen enthält. Seine maximale Kapazität ist eigentlich # 6 # Elektronen, zwei Elektronen für jedes p-Orbital.
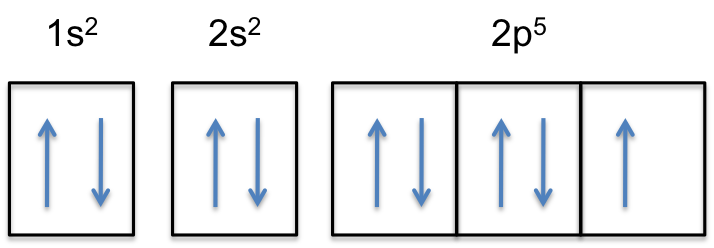
Dies bedeutet, dass die #Farbe(rot)(„zusätzliches Elektron“)# zu einem der drei 2p-Orbitale hinzugefügt wird, sagen wir zu #2p_y#.
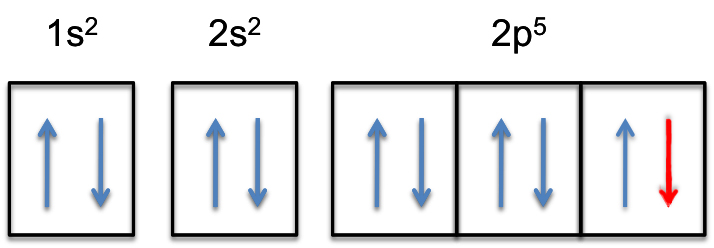
Die 2p-Subshell ist nun vollständig gefüllt, d.h. sie fasst #6# Elektronen.
Die Elektronenkonfiguration des Fluoridanions ist somit
#Farbe(grün)(/bar(ul(Farbe(weiß)(a/ a)Farbe(schwarz)(„F“ ^(-):farbe (weiß) (a) 1s ^ 2Farbe (weiß) (a) 2s ^ 2 Farbe (weiß) (a)2p^ 6)Farbe (weiß)(a/ a)|)))#
Beachten Sie, dass das Fluoridanion insgesamt # 8 # Elektronen in seiner zweiten Schale, der äußersten Schale, hat. Dies sagt Ihnen, dass das Anion ein vollständiges Oktett hat.
Da das Fluoridanion mit Neon isoelektronisch ist, #“Ne“#, können Sie seine Elektronenkonfiguration mit der Edelgas-Kurzschreibweise schreiben als
#“F“^(-): #
Hier
## – die Elektronenkonfiguration von Neon