Angenommen, Sie haben dieses Alkylhalogenid und müssen alle Produkte einer E2-Reaktion bestimmen, wenn es mit einer starken Base wie Natriumethoxid behandelt wird.

Denken Sie daran, dass wir bei E2-Reaktionen zuerst alle β-Wasserstoffatome identifizieren und die Eliminationsprodukte basierend auf jedem Satz dieser β-Wasserstoffatome zeichnen werden. In diesem Fall haben wir β-Wasserstoffatome auf der rechten Seite der Abgangsgruppe (Br) und auf den beiden Methylgruppen.

Ein Produkt wird also das Alken sein, bei dem sich die Doppelbindung in der Mitte befindet:

Andererseits ergeben die Wasserstoffatome an jeder Methylgruppe dasselbe Alken, da sie äquivalent sind, wie durch die Symmetrieebene und die Struktur der Alkene bestätigt:

Interessant ist, dass nur eines dieser beiden Alkene das Hauptprodukt ist. Das Verhältnis beträgt etwa 80: 20 zugunsten des stärker substituierten Alkens:

Der Grund dafür ist die Stabilität der Alkene. Denken Sie daran, je mehr substituierte Alkene stabiler sind. Das Hinzufügen von Gruppen an der Doppelbindung erhöht die Stabilität des Alkens:

Bei der Überprüfung unserer Produkte können wir nun feststellen, dass es sich um eine Mischung aus einem dreifach substituierten Alken mit einem zweifach substituierten Alken handelt und das dreifach substituierte Alken das Hauptprodukt dieser Eliminierungsreaktion ist:
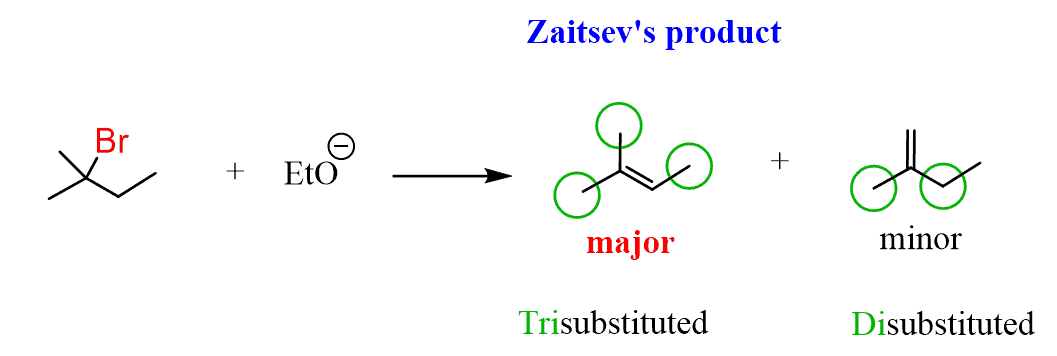
Das stärker substituierte Alken ist also aufgrund seiner höheren Stabilität das Hauptprodukt der E2-Eliminierung.
Der russische Chemiker Alexander Zaitsev war der erste, der dieses Muster beobachtete und die Reaktion ist nach ihm benannt. Die Zaitsev-Regel besagt, dass in einer Eliminationsreaktion das substituiertere Alken das Hauptprodukt ist.
Die Zaitsev-Regel wird in E2-Reaktionen nicht immer befolgt.Wenn wir beispielsweise dasselbe Alkylhalogenid mit einer sterisch gehinderten Base (groß / sperrig) wie beispielsweise dem Kalium-Tert-Butoxid behandeln, sehen wir den entgegengesetzten Trend. Das weniger substituierte Alken ist das Hauptprodukt, obwohl es weniger stabil ist.

Dies ist bekannt als die Hoffmansche Regel, die besagt, dass, wenn wir das Alkylhalogenid (oder andere geeignete Substrate) mit einer starken sterisch gehinderten Base behandeln, das Hauptprodukt das weniger substituierte Alken sein wird.
Der Grund dafür ist, dass es für die sperrige Base einfacher ist, auf die Protonen zuzugreifen, die nicht durch andere Kohlenstoffe behindert werden.Und weil die Protonen der Methylgruppen zugänglicher sind als die Protonen der CH2-Gruppe, bildet sich das weniger substituierte Alken schneller und ist in diesem Fall das Hauptprodukt.Wenn Sie also das stärker substituierte Alken benötigen, verwenden Sie eine sterisch nicht gehinderte Base.
Wenn das durch Hefe substituierte Alken das Ziel ist, verwenden Sie eine sterisch gehinderte Base.

Die häufigsten sterisch gehinderten und nicht gehinderten Basen sind oben gezeigt.
Diese beiden Regeln sind in der organischen Synthese sehr anwendbar, da sie die Kontrolle darüber ermöglichen, welches Alken wir synthetisieren möchten. Und diese Alkene können weiterhin zur Herstellung anderer Produkte verwendet werden.
Regioselektivität der E2-Reaktion
Die Zaitsev- und Hoffman-Regeln demonstrieren das Prinzip der Regioselektivität bei Eliminationsreaktionen.
Regioselektiv bedeutet, dass die Reaktion selektiv ein Regioisomer als Hauptprodukt erzeugt. Die beiden Alkene sind Regioisomere, da die Doppelbindungen in verschiedenen Regionen liegen. Das ist eine Möglichkeit, sich daran zu erinnern, aber auch zu bemerken, dass die Alkene konstitutionelle Isomere sind. Regioselektivität ist also die bevorzugte Bildung eines Konstitutionsisomeren.