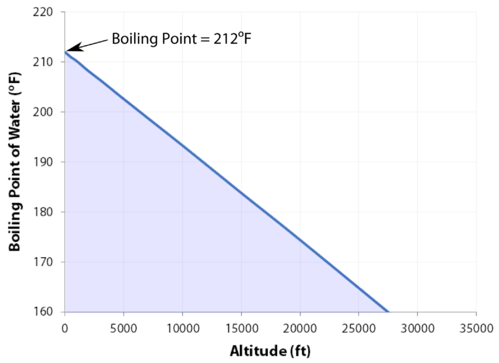
Kiehumispiste
kun nestettä kuumennetaan, sen hiukkasten keskimääräinen kineettinen energia kasvaa. Haihtumisnopeus kasvaa, kun yhä useammat molekyylit pystyvät pakenemaan nesteen pinnalta höyryfaasiin. Lopulta päästään pisteeseen, jossa molekyyleillä on kaikkialla nesteessä riittävästi liike-energiaa höyrystyäkseen. Tässä vaiheessa neste alkaa kiehua. Kiehumispiste on lämpötila, jossa nesteen höyrynpaine on yhtä suuri kuin ulkoinen paine. Alla oleva kuva havainnollistaa nesteen kiehumista.
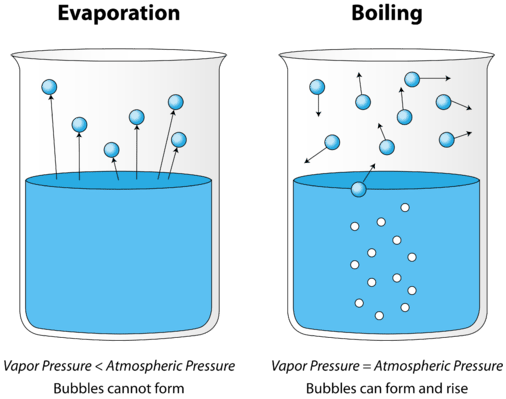
vasemmalla olevassa kuvassa neste on kiehumispisteensä alapuolella, mutta osa nesteestä haihtuu. Oikealla lämpötilaa on nostettu, kunnes nesteen elimistöön alkaa muodostua kuplia. Kun höyrynpaine kuplan sisällä on yhtä suuri kuin ulkoinen Ilmanpaine, kuplat nousevat nesteen pintaan ja puhkeavat. Lämpötila, jossa tämä prosessi tapahtuu, on nesteen kiehumispiste.
normaali kiehumispiste on lämpötila, jossa nesteen höyrynpaine on yhtä suuri kuin standardipaine. Koska ilmanpaine voi muuttua sijainnin perusteella, nesteen kiehumispiste muuttuu ulkoisen paineen myötä. Normaali kiehumispiste on vakio, koska se on määritelty suhteessa ilmakehän vakiopaineeseen \(760 \: \text{mm} \: \ce{Hg}\) (tai \(1 \: \text{atm}\) tai \(101.3 \: \text{kPa}\)).