Redox-reaktioissa on kyse elektronien siirtymisestä aineesta toiseen, joten on hyödyllistä pitää kirjaa siitä, mikä saa ja mikä menettää elektroneja ja kuinka monta elektronia on mukana. Redox-reaktioiden tallennusjärjestelmää kutsutaan Hapetusluvuiksi. Saatat myös muistaa jotain kutsutaan elektronegatiivisuus aiemmista kemian luokat.
elektronegatiivisuus
sitoutuneen atomin kyky houkutella jaettuja elektroneja itseään kohti.
kun kaksi eri alkuaineiden atomia on sitoutunut toisiinsa kovalenttisella sidoksella (jakavat elektronit), elektronit eivät yleensä jakaudu tasan kahden atomin kesken niiden elektronegatiivisuuserojen vuoksi. Ajattele tätä elektronien köydenvetona. Joskus molemmat atomit vetävät yhtä lujasti jaettuja elektroneja; toisinaan on selvästi vahvempi pelaaja, joka vetää elektroneja lähemmäs itseään.
tarkastellaan vetyatomin (jossa on yksi valenssielektroni) ja happiatomin (jossa on kuusi valenssielektronia)välistä sidosta:
|
|
+
|
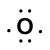 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to vetyatomi. Tämä ei ole elektronien kokonaissiirto, joka synnyttäisi ionin, mutta osittaisvaraukset Kyllä muodostuvat. Sidoksen vetypää on osittain positiivinen (+1), koska se on osittain menettänyt yhden elektronin, ja H–O: n happipää on osittain negatiivinen (-1), koska se on osittain saanut yhden elektronin vedystä:
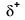 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
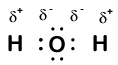
näemme, että kumpikin kahdesta vedystä on ”menettänyt” yhden elektronin hapelle. Happi on ”saanut” kaksi elektronia—yhden jokaisesta vedystä. Nämäkään eivät ole todellisia ioneja, mutta on hyödyllistä ajatella niitä samalla tavalla.
molekyylin atomeille tällä tavalla annettuja varauksia kutsutaan hapetusluvuiksi. Voimme käyttää hapetuslukuja pitääksemme kirjaa siitä, missä elektronit ovat molekyylissä ja miten ne liikkuvat reaktion aikana. Vesiesimerkissämme vedylle annetaan hapetusluku +1, koska jokainen yksittäinen vety on ”menettänyt” yhden elektronin. Hapen hapetusluku on +2, koska yksittäinen happiatomi on ”saanut” yhteensä kaksi elektronia, yhden jokaisesta vedystä.
tässä on toinen molekyyli, johon liittyy vetyä ja happi—vetyperoksidia, H2O2:
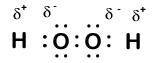
vetyperoksidissa jokaisella vedyllä on edelleen hapetusluku +1, koska jokainen vety ”luovuttaa” yhden elektronin hapelle. Hapen hapetusluku on kuitenkin nyt -1, koska jokainen happi saa viereisestä vedystä vain yhden elektronin. Kahden identtisen happiatomin väliset elektronit jakautuvat tasan, joten kyseisestä sidoksesta ei synny osittaisvarausta.
hapetusluku
molekyylissä tai ionissa olevalle atomille annettu positiivinen tai negatiivinen luku, joka heijastaa elektronien osittaista vahvistumista tai häviämistä.
molekyylin jokaisen yksittäisen alkuaineen hapetusluvun tunteminen on tärkeä askel redox-reaktioiden ymmärtämisessä. Onneksi siihen ei yleensä liity elektronipistekaavioiden piirtämistä. Sen sijaan on olemassa joukko sääntöjä, joiden avulla voimme määrittää hapetusluvut. Tässä tärkeimmät säännöt:
| puhtaan alkuaineen (itsensä, eikä ionin) hapetusluku on nolla. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal hyökkäykseensä. alkalimetallien—alkuaineiden jaksollisen järjestelmän ensimmäisessä sarakkeessa—hapetusluku on aina +1; maa-alkalimetallien (sarake 2) hapetusluku on lähes aina +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
hapen hapetusluku on lähes aina -2, kun se on yhdisteessä. poikkeukset:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
yhdisteen hapetuslukujen summa on nolla. määrittääksemme MN: n hapetusluvun mn2o7: ssä meidän on työskenneltävä taaksepäin:
-2 × 7 atomia = -14 yhteensä koska hapetuslukujen summan on oltava nolla, Mn: n kokonaishapetusluvun on oltava +14 kumotakseen hapen arvon -14, mutta koska atomia on 2 Mn, jokaisen yksittäisen atomin hapetusluku on +7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
polyatomisen ionin hapetuslukujen summa on yhtä suuri kuin kyseisen ionin varaus. taas, työtä taaksepäin määrittää hapetusluku tahansa ei-happi tai ei-vety atomin. määrittääkseen Cr: n hapetusluvun cr2o72 -:
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is on tärkeää huomata, että hapetusluku viittaa aina yhdisteen jokaiseen yksittäiseen atomiin, ei kyseisen alkuaineen kokonaislukuun.
esimerkiksi H2o: ssa molempien vetyatomien positiivinen kokonaisvaraus on +2 (joka tasapainoilee hapesta saadun -2: n kanssa), mutta kummankin vedyn hapetusluku on +1.
Contributions & Attributions
Tämä sivu on rakennettu sisällöstä seuraavien tekijöiden kautta ja libretexts-kehitystiimi on muokannut sen(paikallisesti tai laajasti) vastaamaan Alustan tyyliä, esitystapaa ja laatua:
-
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson ja Jean Dupon.