oppimistavoitteet
- käyttävät solumerkintää kuvaamaan galvaanisia soluja
- kuvaamaan galvaanisten solujen perusosia\
galvaaniset solut, joita kutsutaan myös volttisoluiksi, ovat sähkökemiallisia soluja, joissa spontaanit hapetus-pelkistysreaktiot tuottavat sähköenergiaa. Yhtälöitä kirjoitettaessa on usein kätevää erottaa hapetus-pelkistysreaktiot puolireaktioiksi helpottamaan kokonaisyhtälön tasapainottamista ja korostamaan varsinaisia kemiallisia muunnoksia.
tarkastellaan, mitä tapahtuu, kun hopeanitraattiliuokseen laitetaan puhdas kuparimetallinpala (Kuva \(\PageIndex{1}\)). Heti kun kuparimetallia lisätään, hopeametalli alkaa muodostua ja kupari-ionit siirtyvät liuokseen. Ratkaisun sininen väri äärioikealla osoittaa kupari-ionien läsnäolon. Reaktio voidaan jakaa sen kahteen puolireaktioon. Puolireaktiot erottavat hapetuksen pelkistyksestä, joten kumpaakin voidaan tarkastella erikseen.
pelkistyspuolireaktion yhtälö jouduttiin kaksinkertaistamaan, joten pelkistyspuolireaktiossa ”saadut” elektronit vastasivat hapetuspuolireaktiossa ”menetettyjen” elektronien määrää.

galvaaniset tai volttiset solut sisältävät spontaaneja sähkökemiallisia reaktioita, joissa puolireaktiot erotetaan toisistaan (kuva \(\PageIndex{2}\)) niin, että virta voi virrata ulkoisen johdon läpi. Kuvan vasemmalla puolella olevaa dekantterilasia kutsutaan puolikennoksi, ja se sisältää 1 M kupari(II) nitraattiliuosta, jonka kuparimetalli on osittain uponnut liuokseen. Kuparimetalli on elektrodi. Kupari on hapettumassa; siksi kuparielektrodi on anodi. Anodi on kytketty volttimittariin johtimella ja volttimittarin toinen pääte on kytketty hopeaelektrodiin johtimella. Hopea on pelkistymässä; siksi hopeaelektrodi on katodi. Kuvan oikealla puolella oleva puolikenno koostuu hopeaelektrodista 1 M hopeanitraattiliuoksessa (AgNO3). Tässä vaiheessa ei virtaa-eli elektronien merkittävää liikettä langan läpi ei tapahdu, koska piiri on avoin. Piiri suljetaan suolasillalla, joka välittää virran liikkuvilla ioneilla. Suolasilta koostuu väkevästä, reagoimattomasta elektrolyyttiliuoksesta, kuten tässä esimerkissä käytetystä natriumnitraattiliuoksesta (NaNO3). Elektronien virratessa vasemmalta oikealle elektrodin ja langan läpi nitraatti-ionit (anionit) kulkevat vasemmalla olevan huokoisen tulpan läpi kupari(II) nitraattiliuokseen. Tämä pitää vasemmalla olevan dekantterilasin sähköisesti neutraalina neutraloimalla kupari(II) ionien varauksen, joka syntyy liuoksessa kuparimetallin hapettuessa. Samaan aikaan nitraatti-ionit siirtyvät vasemmalle, natriumionit (kationit) siirtyvät oikealle, huokoisen tulpan läpi ja oikealla olevaan hopeanitraattiliuokseen. Nämä lisätyt kationit ”korvaavat” hopeaionit, jotka poistuvat liuoksesta pelkistyessään hopeametalliksi, pitäen dekantterilasi oikealla sähköisesti neutraalina. Ilman suolasiltaa osastot eivät pysyisi sähköisesti neutraaleina eikä merkittävää virtaa virtaisi. Suolasiltaa ei kuitenkaan tarvita, jos molemmat osastot ovat suorassa kosketuksessa. Kun piiri on valmis, volttimittari lukee +0,46 V, tätä kutsutaan solupotentiaaliksi. Kennopotentiaali syntyy kahden erilaisen metallin liittyessä toisiinsa, ja se mittaa hapetus-pelkistysreaktiosta saatavaa energiaa per varausyksikkö. Voltti on johdettu SI-yksikkö sähköiselle potentiaalille
\
tässä yhtälössä A on virta ampeereina ja C varaus coulombeina. Huomaa, että voltit on kerrottava varauksella coulombeina (C), jotta saadaan energia jouleina (J).
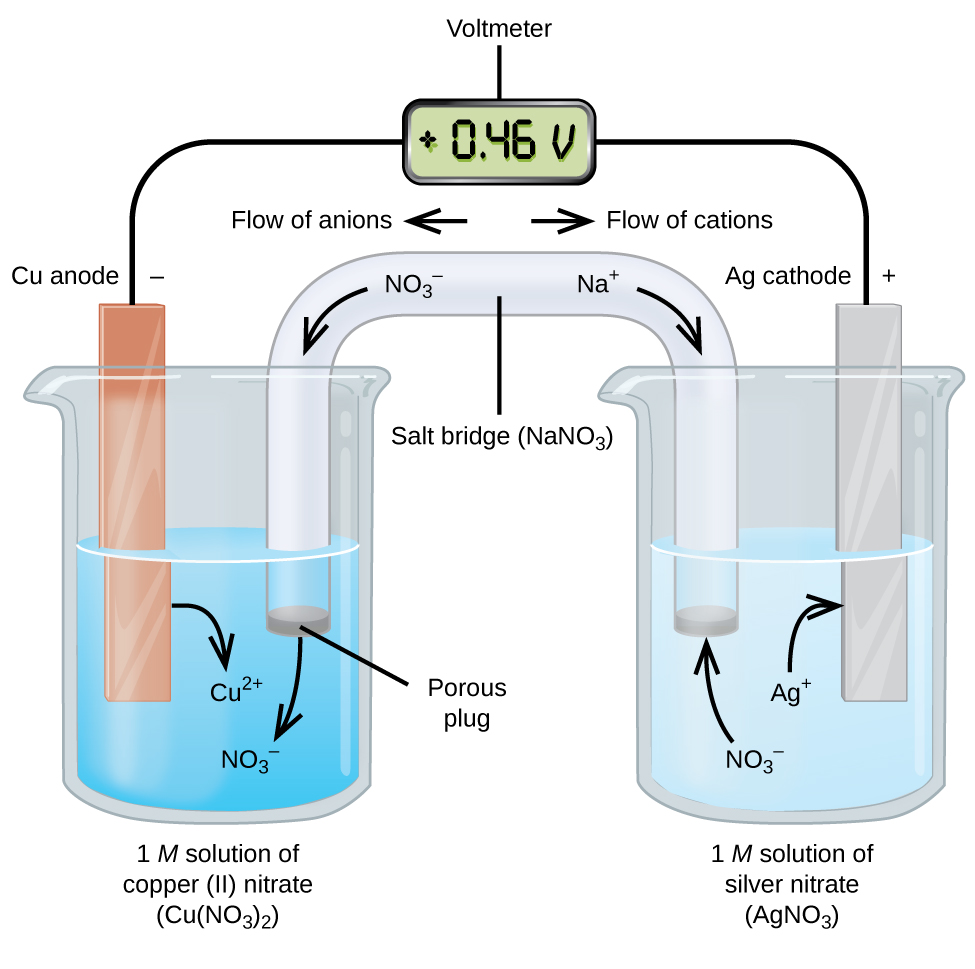
kun sähkökemiallinen kenno rakentuu tällä tavalla, positiivinen kennopotentiaali kertoo spontaanista reaktiosta ja siitä, että elektronit virtaavat vasemmalta oikealle. On paljon meneillään Kuvassa \(\PageIndex{2}\), joten on hyödyllistä tiivistää asioita tämän järjestelmän:
- elektronit virtaavat anodilta katodille: vasemmalta oikealle kuvan galvaanisessa standardikennossa.
- vasemman puolikennon elektrodi on anodi, koska hapettuminen tapahtuu tässä. Nimi viittaa suolasillan anionien virtaukseen sitä kohti.
- oikean puolikennon elektrodi on katodi, koska pelkistyminen tapahtuu tässä. Nimi viittaa kationien virtaukseen suolasillassa sitä kohti.
- hapettuminen tapahtuu anodilla (kuvassa vasemmalla puolikennolla).
- pelkistyminen tapahtuu katodilla (kuvassa oikealla puolisolulla).
- solupotentiaali, +0,46 V, johtuu tässä tapauksessa kahden puolisolun valmistamiseen käytettyjen materiaalien luontaisista eroista.
- suolasillan on oltava läsnä piirin sulkemiseksi (täydentämiseksi) ja sekä hapettumisen että pelkistymisen on tapahduttava virran virtaamiseksi.
mahdollisia galvaanisia soluja on monia, joten niiden kuvaamiseen käytetään yleensä pikakirjoitusta. Solun notaatio (jota kutsutaan joskus solukaavioksi) antaa tietoa reaktioon osallistuvista eri lajeista. Tämä merkintä toimii myös muiden solujen. Pystyviiva │ merkitsee vaiherajaa ja kaksoisviiva ‖ suolasiltaa. Tiedot anodista kirjoitetaan vasemmalle, jota seuraa anodiliuos, sitten suolasilta (kun on), sitten katodiliuos ja lopuksi tiedot katodista oikealle. Galvaanisen solun solumerkintä Kuvassa \(\PageIndex{2}\) on tällöin
\
huomaa, että spectator-ioneja ei ole mukana ja että käytettiin yksinkertaisinta muotoa jokaisesta puolireaktiosta. Kun tiedetään, lasketaan mukaan yleensä eri ionien alkupitoisuudet.
yksi yksinkertaisimmista soluista on Daniellin solu. Tämä akku on mahdollista rakentaa asettamalla kuparielektrodi purkin pohjalle ja peittämällä metalli kuparisulfaattiliuoksella. Kuparisulfaattiliuoksen päälle leijutetaan sinkkisulfaattiliuosta, minkä jälkeen sinkkielektrodi asetetaan sinkkisulfaattiliuokseen. Kuparielektrodin liittäminen sinkkielektrodiin mahdollistaa sähkövirran virtaamisen. Tämä on esimerkki solusta, jossa ei ole suolasiltaa, ja ionit voivat virrata näiden kahden liuoksen välisen rajapinnan poikki.
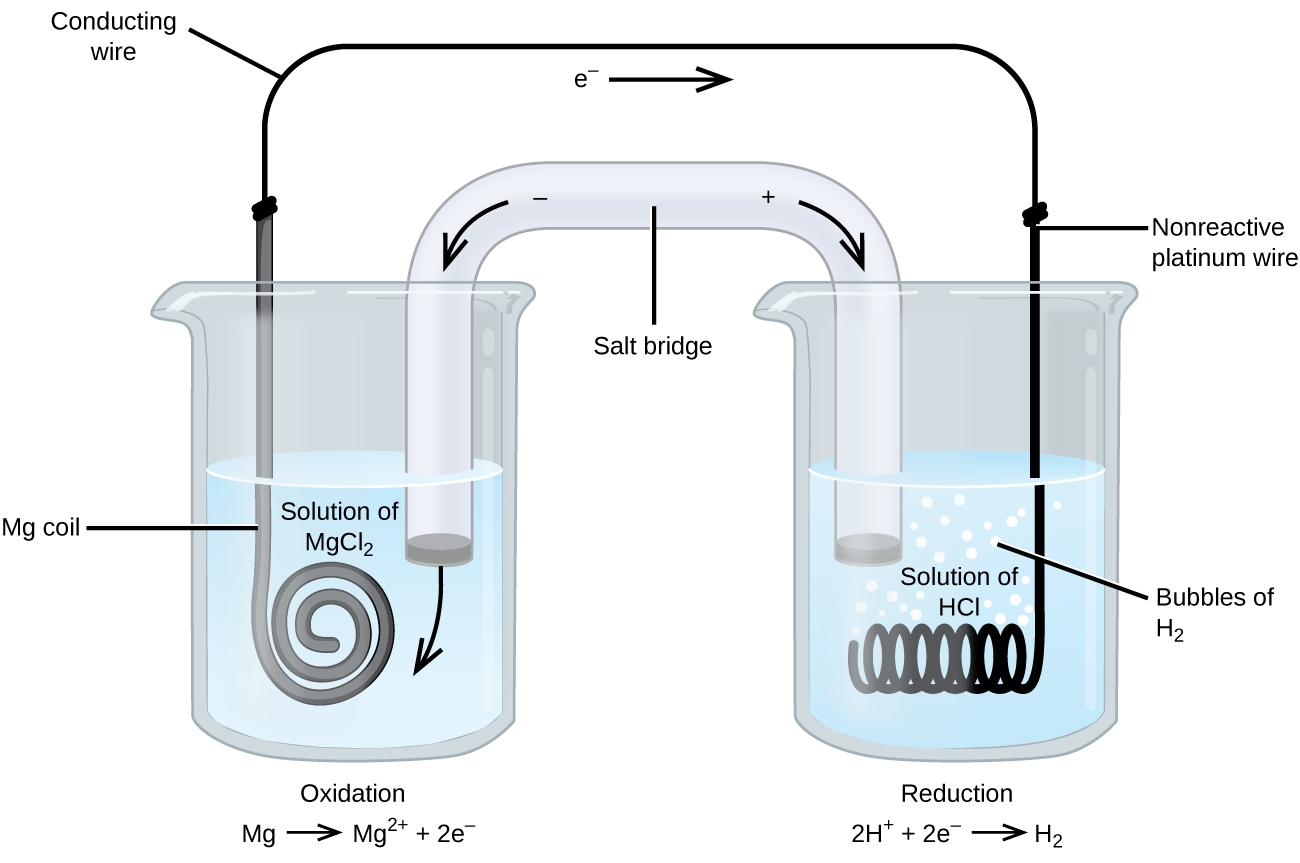
joihinkin hapetus-pelkistysreaktioihin liittyy lajeja, jotka ovat sähkön huonoja johtimia, joten käytetään elektrodia, joka ei osallistu reaktioihin. Usein elektrodi on platinaa, kultaa tai grafiittia, jotka kaikki ovat inerttejä monille kemiallisille reaktioille. Yksi tällainen järjestelmä on esitetty kuvassa \(\PageIndex{3}\). Magnesium hapettuu kuvassa vasemmalla olevalla anodilla ja vetyionit pelkistyvät oikealla olevalla katodilla. Reaktio voidaan tiivistää seuraavasti:
kenno käytti inerttiä platinalankaa katodille, joten kennon notaatio on
magnesiumelektrodi on aktiivinen elektrodi, koska se osallistuu hapetus-pelkistysreaktioon. Inertit elektrodit, kuten Platinaelektrodi Kuvassa \(\PageIndex{3}\), eivät osallistu hapetus-pelkistysreaktioon ja ovat läsnä niin, että virta voi virrata kennon läpi. Platina tai kulta ovat yleensä hyviä inerttejä elektrodeja, koska ne ovat kemiallisesti reagoimattomia.
esimerkki \(\PageIndex{1}\): käyttäen solun notaatiota
tarkastellaan galvaanista solua, joka koostuu
\
Kirjoita hapetus-ja pelkistyspuolireaktiot ja kirjoita reaktio solun notaatiota käyttäen. Mikä reaktio tapahtuu anodilla? Katodi?
liuos
tarkastuksessa Cr hapettuu, kun kolme elektronia katoaa muodostaen Cr3+: n, ja Cu2+ pelkistyy, kun se saa kaksi elektronia muodostaen Cu: n. Varauksen tasapainottaminen antaa
\
solun notaatio käyttää kunkin yhtälön yksinkertaisinta muotoa ja alkaa reaktiolla anodilla. Pitoisuuksia ei määritelty, joten:
\
hapettuminen tapahtuu anodilla ja pelkistyminen katodilla.
esimerkki \(\PageIndex{2}\): Käyttämällä solun notaatiota
tarkastellaan galvaanista solua, joka koostuu
Kirjoita hapetus-ja pelkistyspuolireaktiot ja kirjoita reaktio solun notaatiota käyttäen. Mikä reaktio tapahtuu anodilla? Katodi?
liuos
tarkastuksessa Fe2+ käy läpi hapettumisen, kun yksi elektroni katoaa muodostaen Fe3+: n, ja MnO4− pelkistyy saadessaan viisi elektronia muodostaen Mn2+: n. Varauksen tasapainottaminen antaa
\
solun notaatio käyttää kunkin yhtälön yksinkertaisinta muotoa ja alkaa reaktiolla anodilla. On tarpeen käyttää inerttiä elektrodia, kuten platinaa, koska siinä ei ole metallia, joka johtaisi elektronit anodilta katodille. Pitoisuuksia ei määritelty, joten:
\
hapettuminen tapahtuu anodilla ja pelkistyminen katodilla.
Exercise \(\PageIndex{1}\)
käyttää solumerkintää kuvaamaan galvaanista solua, jossa kupari(II) ionit pelkistyvät kuparimetalliksi ja sinkkimetalli hapettuu sinkki-ioneiksi.
vastaus
ongelmasta annetuista tiedoista:
\
käyttäen solumerkintää:
\
Yhteenveto
sähkökemialliset solut koostuvat tyypillisesti kahdesta puolikennosta. Puolisolut erottavat hapetuspuolireaktion pelkistyspuolireaktiosta ja mahdollistavat virran kulun ulkoisen langan läpi. Yksi puoli-solu, yleensä kuvattu vasemmalla puolella kuvassa, sisältää anodi. Hapettuminen tapahtuu anodilla. Anodi on kytketty katodiin toisessa puolikennossa, joka usein näkyy oikealla puolella kuvassa. Pelkistys tapahtuu katodilla. Suolasillan lisääminen täydentää virtapiirin, jolloin virta pääsee virtaamaan. Suolasillan anionit virtaavat kohti anodia ja suolasillan kationit kohti katodia. Näiden ionien liike täydentää piirin ja pitää jokaisen puolikennon sähköisesti neutraalina. Sähkökemiallisia soluja voidaan kuvata solumerkinnällä. Tässä notaatiossa vasemmalla näkyy tieto reaktiosta anodilla ja oikealla tieto reaktiosta katodilla. Suolasiltaa edustaa kaksoisviiva,‖. Puolikennossa olevat kiinteät, nestemäiset tai vesifaasit erotetaan toisistaan yhdellä viivalla,│. Eri lajien vaihe ja konsentraatio on mukana lajinimen jälkeen. Hapetus-pelkistysreaktioon osallistuvia elektrodeja kutsutaan aktiivisiksi elektrodeiksi. Elektrodit, jotka eivät osallistu hapetus-pelkistysreaktioon, mutta jotka mahdollistavat virran kulun, ovat inerttejä elektrodeja. Inertit elektrodit valmistetaan usein platinasta tai kullasta, jotka säilyvät muuttumattomina monissa kemiallisissa reaktioissa.
Sanasto
aktiivinen elektrodi elektrodi, joka osallistuu sähkökemiallisen kennon hapetus-pelkistysreaktioon; aktiivisen elektrodin massa muuttuu hapetus-pelkistysreaktion aikana anodielektrodissa sähkökemiallisessa kennossa, jossa hapettuminen tapahtuu; anodia koskevat tiedot tallennetaan suolasillan vasemmalle puolelle solun notaatiokatodielektrodiin sähkökemiallisessa kennossa, jossa pelkistyminen tapahtuu; katodia koskevat tiedot kirjataan suolasillan oikealle puolelle solun notaatiokennon notaatioon pikakirjoituksella tavalla, joka edustaa reaktioita sähkökemiallisessa solukennossa potentiaalieroa sähköisessä potentiaalissa, joka syntyy, kun erilaisia metalleja kytketään toisiinsa; varausvirtauksen (virran) käyttövoima hapetus-pelkistysreaktioissa galvaaninen solun sähkökemiallinen solu, johon liittyy spontaani hapetus-pelkistysreaktio; sähkökemialliset solut, joilla on positiivisia solupotentiaaleja; kutsutaan myös volttikennoksi inertti elektrodi elektrodi, joka mahdollistaa virran virtauksen, mutta joka ei muuten osallistu hapetus-pelkistysreaktioon sähkökemiallisessa kennossa; inertin elektrodin massa ei muutu hapetus-pelkistysreaktion aikana; inertit elektrodit valmistetaan usein platinasta tai kullasta, koska nämä metallit ovat kemiallisesti reagoimattomia. voltaic cell another name for a galvanic cell
Contributors and Attributions
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributors. OpenStax Collegen tuottama oppikirjasisältö on lisensoitu Creative Commons Attribution License 4.0-lisenssillä. Lataa ilmaiseksi osoitteesta http://cnx.org/contents/85abf193-2bd…[email protected]).