entsymaattisen katalyysin mekanismit
substraatin sitoutuminen entsyymin aktiiviseen kohtaan on hyvin spesifinen vuorovaikutus. Aktiiviset paikat ovat entsyymin pinnalla olevia halkeamia tai uria, jotka koostuvat yleensä polypeptidiketjun eri osien aminohapoista, jotka ovat kokoontuneet yhteen Taitetun proteiinin tertiäärirakenteessa. Substraatit sitoutuvat aktiiviseen kohtaan aluksi ei-kovalenttisilla vuorovaikutuksilla, kuten vetysidoksilla, ionisidoksilla ja hydrofobisilla vuorovaikutuksilla. Kun substraatti on sitoutunut entsyymin aktiiviseen kohtaan, useat mekanismit voivat nopeuttaa sen muuntumista reaktion tuotteeksi.
vaikka edellisessä jaksossa käsitellyssä yksinkertaisessa esimerkissä oli mukana vain yksi substraattimolekyyli, useimmissa biokemiallisissa reaktioissa on kyse kahden tai useamman eri substraatin välisistä vuorovaikutuksista. Esimerkiksi peptidisidoksen muodostumiseen liittyy kahden aminohapon liittyminen. Tällaisissa reaktioissa kahden tai useamman substraatin sitoutuminen aktiiviseen kohtaan oikeassa asennossa ja suunnassa nopeuttaa reaktiota (Kuva 2.23). Entsyymi tarjoaa mallin, johon reaktantit saatetaan yhteen ja oikein suunnataan suosimaan siirtymätilan muodostumista, jossa ne vuorovaikuttavat.

Kuva 2.23
kahden substraatin välisen reaktion entsymaattinen katalyysi. Entsyymi muodostaa mallin, jolla kaksi substraattia saatetaan yhteen sopivaan asentoon ja orientaatioon reagoidakseen keskenään.
entsyymit nopeuttavat reaktioita myös muuttamalla substraattiensa konformaatiota niin, että ne lähestyvät siirtymätilaa. Yksinkertaisin entsyymi-substraatti-vuorovaikutuksen malli on lock-and-key-malli, jossa substraatti sopii tarkasti aktiiviseen kohtaan (Kuva 2.24). Monissa tapauksissa sekä entsyymin että substraatin kokoonpanoja kuitenkin muokataan substraattisidoksella, jota kutsutaan indusoiduksi fit-prosessiksi. Tällöin substraatin konformaatio muuttuu niin, että se muistuttaa enemmän siirtymätilaa. Tällaisen substraatin vääristymisen tuottama jännitys voi edelleen helpottaa sen muuntumista siirtymätilaan heikentämällä kriittisiä sidoksia. Lisäksi siirtymätilaa vakauttaa sen tiivis sitoutuminen entsyymiin, jolloin aktivaation vaatima energia laskee.

kuva 2.24
entsyymien ja substraattien yhteisvaikutusmallit. A) lock-and-key-mallissa substraatti sopii tarkasti entsyymin aktiiviseen kohtaan. B) indusoituneessa fit-mallissa substraatin sitoutuminen vääristää sekä substraatin että entsyymin konformaatioita. Tämä vääristymä (lisää…)
sen lisäksi, että useat substraatit yhdistyvät ja substraattien konformaatio vääristyy siirtymätilaa lähestyttäessä, monet entsyymit osallistuvat suoraan katalyyttiseen prosessiin. Tällöin aktiivisen kohdan spesifiset aminohapposivuketjut voivat reagoida substraatin kanssa ja muodostaa sidoksia reaktiovälitteiden kanssa. Happamat ja emäksiset aminohapot ovat usein mukana näissä katalyyttisissä mekanismeissa, mikä käy ilmi seuraavasta kymotrypsiinin käsittelystä esimerkkinä entsymaattisesta katalyysistä.
kymotrypsiini kuuluu entsyymiperheeseen (seriiniproteaasit), joka pilkkoo proteiineja katalysoimalla peptidisidosten hydrolyysiä. Reaktio voidaan kirjoittaa seuraavasti:

seriiniproteaasiperheen eri jäsenillä (mukaan lukien kymotrypsiini, trypsiini, elastaasi ja trombiini) on erilliset substraattispesifisyydet; ne pilkkovat mieluiten peptidisidoksia eri aminohappojen vierestä. Esimerkiksi siinä missä kymotrypsiini sulattaa sidoksia hydrofobisten aminohappojen, kuten tryptofaanin ja fenyylialaniinin, vierestä, trypsiini sulattaa sidoksia emäksisten aminohappojen, kuten lysiinin ja arginiinin vierestä. Kaikki seriiniproteaasit ovat kuitenkin rakenteeltaan samanlaisia ja käyttävät samaa katalyysimekanismia. Näiden entsyymien aktiivisissa kohdissa on kolme kriittistä aminohappoa—seriini, histidiini ja aspartaatti—jotka ajavat peptidisidoksen hydrolyysiä. Näitä entsyymejä kutsutaankin seriiniproteaaseiksi seriinijäämän keskeisen roolin vuoksi.
substraatit sitoutuvat seriiniproteaasiin lisäämällä pilkkoutumiskohdan vieressä olevaa aminohappoa entsyymin aktiivisen kohdan taskuun (Kuva 2.25). Tämän taskun luonne määrittää seriiniproteaasiperheen eri jäsenten substraattispesifisyyden. Esimerkiksi kymotrypsiinin sitova tasku sisältää hydrofobisia aminohappoja, jotka vuorovaikuttavat sen suosimien substraattien hydrofobisten sivuketjujen kanssa. Sen sijaan trypsiinin sidostaskussa on negatiivisesti varautunut hapan aminohappo (aspartaatti), joka pystyy muodostamaan ionisidoksen substraattiensa lysiini-tai arginiinijäämien kanssa.
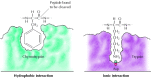
kuva 2, 25
substraattiin sitoutuminen seriiniproteaasien avulla. Halkaistavan peptidisidoksen viereinen aminohappo työnnetään entsyymin aktiivisessa kohdassa olevaan taskuun. Kymotrypsiinissä tasku sitoo hydrofobisia aminohappoja; trypsiinin sitova tasku sisältää (lisää…)
substraatin sitoutumispaikat peptidisidos, joka halkaistaan aktiivisen kohdan seriinin viereen (Kuva 2.26). Tämän seriinin protoni siirtyy aktiiviseen kohtaan histidiiniin. Aktiivisen kohdan konformaatio suosii tätä protoninsiirtoa, koska histidiini vuorovaikuttaa negatiivisesti varautuneen aspartaattijäämän kanssa. Seriini reagoi substraatin kanssa muodostaen tetraedrisen siirtymätilan. Tämän jälkeen peptidisidos pilkkoutuu ja substraatin C-terminaalinen osa vapautuu entsyymistä. N-terminaalinen peptidi pysyy kuitenkin sitoutuneena seriiniin. Tämä tilanne ratkeaa, kun vesimolekyyli (toinen substraatti) tulee aktiiviseen kohtaan ja kumoaa edeltävät reaktiot. Vesimolekyylin protoni siirtyy histidiinille ja sen hydroksyyliryhmä siirtyy peptidille muodostaen toisen tetraedrisen siirtymätilan. Tämän jälkeen protoni siirtyy histidiiniltä takaisin seriiniksi ja peptidi vapautuu entsyymistä, jolloin reaktio päättyy.

Kuva 2.26
kymotrypsiinin katalyyttinen mekanismi. Kolme aminohappoa aktiivisessa kohdassa (ser-195, His-57 ja Asp-102) ovat kriittisessä roolissa katalyysissä.
Tämä esimerkki kuvaa useita entsymaattisen katalyysin piirteitä; entsyymi-substraatti-vuorovaikutusten spesifisyyttä, eri substraattimolekyylien sijoittumista aktiiviseen kohtaan sekä aktiivisen kohdan jäämien osallistumista siirtymätilan muodostumiseen ja stabilointiin. Vaikka solujen tuhannet entsyymit katalysoivat monenlaisia kemiallisia reaktioita, niiden toimintaan pätevät samat perusperiaatteet.