U. S. Pharm. 2008; 33(4)(onkologia suppl):20-30.
Abstrakti: noin 75% postmenopausaalisista rintasyöpää sairastavista naisista sairastaa hormonireseptoripositiivista (HR+) tautia.1 tamoksifeeni oli postmenopausaalisten naisten HR+ – rintasyövän hoidon standardi selektiivisten kolmannen sukupolven aromataasin estäjien, jotka ovat anastrotsoli, letrotsoli ja eksemestaani, tuloon asti.3, 4 näillä lääkeaineilla on kliinisissä tutkimuksissa todettu parempi taudista vapaa elinaika kuin tamoksifeenilla, mutta niiden hyötyä ei ole osoitettu yli viiden vuoden ajan postmenopausaalisilla naisilla, joilla on HR+-rintasyöpä.3,4
on arvioitu, että kolmella neljäsosalla postmenopausaalisista rintasyöpää sairastavista naisista on hormonireseptoripositiivinen (HR+) sairaus.1 tamoksifeeni-selektiivinen estrogeenireseptorimodulaattori, jolla on estrogeenisiä vaikutuksia luuhun, kohdun limakalvon kudokseen ja lipideihin ja anti!= estrogeenisiä vaikutuksia rintakudokseen–oli normaali hoito HR + rintasyöpä postmenopausaalisilla naisilla, kunnes otettiin käyttöön selektiiviset kolmannen sukupolven aromataasi-inhibiittorit (AIs).2-4 nämä lääkeaineet (anastrotsoli, letrotsoli ja eksemestaani) ovat kliinisissä tutkimuksissa osoittaneet paremman tautivapaan eloonjäämisen (DFS) kuin tamoksifeeni.3, 4 tamoksifeenin käyttöön liittyvät haittavaikutukset (endometriumsyöpä, tromboemboliset komplikaatiot ja tamoksifeeniresistenssi) ovat kannustaneet kehittämään hoitomuotoja, joilla on erilainen vaikutusmekanismi, kuten AIs.2
katso taulukosta 1 Yhteenveto kolmannen sukupolven AIs: ää koskevista tärkeistä tiedoista.
Background
skotlantilainen kirurgi George Beatson kuvaili estrogeenien hormonaalista osuutta karsinogeneesissä suhteessa rintasyöpään vuonna 1896.5 Beatson tunnusti, että munasarjojen poisto (ooforektomia) oli hyödyllistä naisilla, joilla oli hoitamaton rintasyöpä.5 Tämä kirurgisesti indusoitu estrogeenivajeen tila edesauttoi kasvaimen kasvun estämistä rintasyöpäsoluissa naisilla, joilla on HR+ – tauti.5
aminoglutetimidi, joka alun perin muotoiltiin epilepsialääkkeeksi, oli ensimmäinen epäspesifinen tekoäly, jota alun perin markkinoitiin 1970-luvun lopulla toisen linjan lääkeaineena tamoksifeenin jälkeen postmenopausaalisilla naisilla, joilla oli pitkälle edennyt HR+ rintasyöpä.6 myrkylliset haittavaikutukset, kuten lisämunuaiskuoren vajaatoiminta ja steroidihoidon välttämättömyys johtivat aminoglutetimidin poistumiseen markkinoilta.6 postmenopausaalisilla naisilla, joilla on varhais – ja myöhäisvaiheen HR+ rintasyöpä, kolmannen sukupolven AIs: llä on parempi toksisuusprofiili, selektiivisyys, teho ja kliininen teho verrattuna vanhempiin lääkeaineisiin. 6
Luokitus4,7
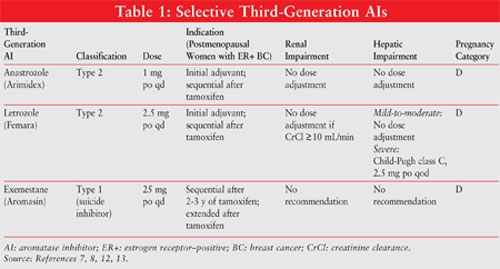
AIs on luokiteltu tyypin 1 steroideihin kuulumattomiksi (kilpailukyvyttömiksi, palautumattomiksi) tai tyypin 2 steroideihin kuulumattomiksi (kilpaileviksi, palautuviksi) estäjiksi. Tyypin 1 inhibiittori eksemestaani sitoutuu peruuttamattomasti aromataasimolekyylin kohtaan ja tunnetaan itsemurhan estäjänä. Tyypin 2 inhibiittorit anastrotsoli ja letrotsoli sitoutuvat reversiibelisti aromataasiksi. Katso kuva 1 eri AIs: n kemialliset rakenteet.
vaikutusmekanismi
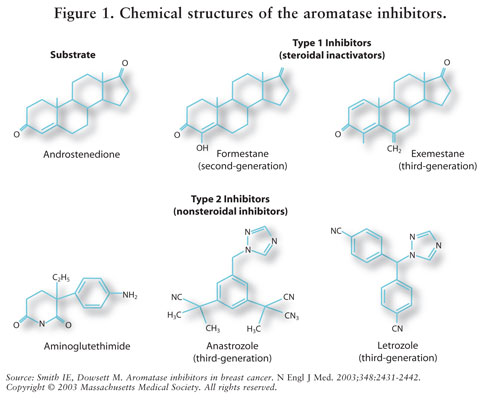
estrogeenisynteesiä välittää aromataasientsyymi.7 aromataasi muuntaa androstenedionin ja testosteronin estroniksi ja estradioliksi.5,7 AIs vähentää estrogeenia postmenopausaalisilla naisilla estäen siten sen karsinogeenista vaikutusta rintakudokseen.7 koska premenopausaalisten naisten munasarjat toimivat edelleen, AIs: ää ei ole tarkoitettu tälle väestölle kliinisten tutkimusten ulkopuolella; näillä naisilla AIs stimuloisi hypotalamusta ja aivolisäkettä gonadotropiinien tuotannon lisäämiseksi.4 ks. kuva 2.
Toksisuus6,8
AIs: n haittavaikutuksia ovat muun muassa kardiovaskulaariset häiriöt, kuten verenpainetauti, vasodilataatio, turvotus, ja rintakipua. Lisätutkimuksia tarvitaan AIs: n täyden vaikutuksen arvioimiseksi sydämen toimintaan. Potilailla voi esiintyä luun mineraalitiheyden laskua, lisääntynyttä murtumariskiä, vasomotorisia oireita, emättimen kuivuutta, muskuloskeletaalista kipua, päänsärkyä, unettomuutta, masennusta, lisääntynyttä yskää, hengenahdistusta, maha-suolikanavan epämukavuutta, painonnousua ja mahdollisesti kohonneita rasva-arvoja. Luukato on vallitseva haittavaikutus; sen vastapainoksi on käytetty bisfosfonaatteja, kuten tsoledronihappoa. AIs-potilaiden tulee saada D-vitamiini-ja kalsiumlisää. LINTUINFLUENSSAHOIDOSTA aiheutuvia pitkittyneitä haittavaikutuksia ja vaikutuksia kognitiivisiin toimintoihin ei ole vielä selvitetty.AIs on vasta-aiheinen raskaana oleville naisille.
lääkeinteraktiot
anastrotsoli estää CYP1A2: ta, CYP2C9: ää ja CYP3A4: ää.10, 11 Letrotsoli metaboloituu CYP2A6: n ja CYP2C19: n välityksellä, ja eksemestaani metaboloi CYP3A4: ää.8, 10-13 CYP3A4: n indusoijat kuten rifampiini, fenytoiini, karbamatsepiini ja mäkikuisma voivat aiheuttaa eksemestaanipitoisuuksien laskua, jos niitä annetaan samanaikaisesti. 8, 12, 13 tamoksifeeni aiheuttaa 38%: n laskun letrotsolin määrässä ja 27%: n laskun anastrotsolin määrässä, kun sitä annetaan samanaikaisesti.2, 7, 8, 14
käyttöaiheet ja annostelu
anastrotsoli 10, 11: anastrotsoli 1 mg kerran vuorokaudessa on tarkoitettu varhaisvaiheen rintasyövän hoitoon ensimmäisenä liitännäishoitona postmenopausaalisilla naisilla, joilla on hormonaalisesti herkkä sairaus ja ensimmäisenä hoitona HR+ tai HR-tuntematon metastaattinen tai paikallisesti edennyt sairaus. Se on myös hyväksytty käytettäväksi tamoksifeenihoidon jälkeen naisilla, joilla on etenevä sairaus. Annoksen muuttaminen ei ole tarpeen munuaisten vajaatoiminnassa tai lievässä tai kohtalaisessa maksan vajaatoiminnassa.
Letrotsole11,12: Letrotsoli 2.5 mg kerran vuorokaudessa on tarkoitettu postmenopausaalisille naisille, joilla on HR+ varhaisvaiheen rintasyöpä aloitushoitona tai laajennettuna liitännäishoitona tamoksifeenin jälkeen. Se on myös tarkoitettu HR+ tai HR-tuntematon metastaattinen tauti. Annoksen muuttamista suositellaan vaikeassa maksan vajaatoiminnassa.
Exemestane11,14: eksemestaani 25 mg po kerran päivässä on tarkoitettu liitännäishoitona kahden-kolmen vuoden ajan tamoksifeenin jälkeen postmenopausaalisille naisille, joilla on HR+ varhainen rintasyöpä, yhteensä viiden peräkkäisen vuoden ajan hormonihoitoa. Sitä voidaan käyttää myös tamoksifeenihoidon jälkeen edenneeseen sairauteen. Se tulee ottaa aterian jälkeen. Annosta ei tarvitse muuttaa maksan tai munuaisten vajaatoiminnassa
kliiniset tutkimukset
tamoksifeeniin liittyvät toksisuudet, kuten endometriumsyöpä, johtivat laajamittaisten kliinisten tutkimusten aloittamiseen, joissa tutkittiin kolmannen sukupolven AIs: n käyttöä postmenopausaalisilla naisilla, joilla oli HR+ rintasyöpä. Näiden aineiden tehon arvioimiseksi tamoksifeeniin verrattuna käytettiin erilaisia koemalleja.6 parempi tulos kliinisen tehokkuuden ja toksisuusprofiilien suhteen vahvisti AIs: n uudeksi adjuvanttihoidon standardiksi postmenopausaalisilla naisilla, joilla on HR+ rintasyöpä.6
ATAC15: Atac (Arimidex, tamoksifeeni yksin tai yhdistelmänä), satunnaistetussa kaksoissokkotutkimuksessa verrattiin kolmea hoitohaaraa: tamoksifeeni 20 mg + anastrotsoli lumelääke, anastrotsoli 1 mg + tamoksifeeni lumelääke ja tamoksifeeni 20 mg + anastrotsoli 1 mg yhdistelmähoito. Ensisijaisena tavoitteena oli arvioida tamoksifeenin turvallisuutta ja tehoa verrattuna anastrotsoliin ja anastrotsolin ja tamoksifeenin yhdistelmään viiden vuoden aikana. Yhteensä 9 366 potilasta–3 125 potilasta anastrotsoliryhmässä, 3 116 potilasta tamoksifeeniryhmässä ja 3 125 potilasta yhdistelmähoidossa–hoidettiin 33 kuukauden mediaanin ajan.
kolmen vuoden kuluttua anastrotsolin HUONONEMISKERROIN oli 89, 4% verrattuna tamoksifeenin 87, 4%: iin (riskisuhde 0 , 83, 95% CI, P =.013). Anastrotsoli vähensi kontralateraalisen rintasyövän (KLBC) esiintyvyyttä tamoksifeeniin verrattuna (odds ratio 0, 42 , 95% CI, P =.007). Yhdistelmähoito suljettiin, koska tamoksifeenin lisäksi ei havaittu kliinistä hyötyä. Anastrotsolin käyttöön liittyi haittavaikutuksia, kuten kohdun limakalvon syöpää (P =.02), valkovuoto, erite (p <.0001), aivoverenkiertohäiriöt (P =.0006), laskimotromboemboliset tapahtumat (P =.0006), ja kuumia aaltoja (p <.0001); tamoksifeeniin liittyi vähemmän murtumia ja vähemmän nivelkipuja (p <.0001). 68 kuukauden kuluttua anastrotsoli lisäsi DFS: ää (HR 0, 87, 95% CI, P =.01) ja toistumisaika (HR 0, 79, 95% CI, P =.0005) ja etäispesäkkeiden väheneminen (HR 0, 86, 95% CI, P =.04) ja KLBC (42% lasku, P =.01).16 kun seurantavälin mediaani oli 100 kuukautta, ANASTROTSOLIPOTILAAT osoittivat DFS: n paranevan (HR 0, 85; P =.003), KLBC: n esiintyminen (HR 0, 60, P =.004), toistumisaika (HR 0, 76, P =.0001), ja aika kaukaiseen toistumiseen (HR 0.84, P =.022) verrattuna tamoksifeenia saaneisiin potilaisiin. Absoluuttinen ero toistumisprosenteissa parani 2.Kahdeksan prosenttia viiden vuoden jälkeen 4,8 prosenttiin yhdeksän vuoden kuluttua. Anastrotsolimurtumien määrä oli suurempi hoidon aikana, mutta ero pieneni huomattavasti 100 kuukauden seurantajakson jälkeen. Pidennetyllä hoitojaksolla murtumariski oli anastrotsolilla 1, 15 ja tamoksifeenilla 1, 02. Endometriumsyövän riski pieneni anastrotsolihoidon yhteydessä ja sen jälkeen tamoksifeeniin verrattuna, ja vuotuinen esiintyvyys oli 0, 043 verrattuna 0, 14: ään ja 0, 014: ään verrattuna 0, 12: een. Kokonaiselinajan (OS) eroa ei ole havaittu.
MA.1712,17: MA.17 oli satunnaistettu, lumekontrolloitu kaksoissokkotutkimus, jossa arvioitiin viiden vuoden letrotsolihoidon tehokkuutta postmenopausaalisilla rintasyöpää sairastavilla naisilla, jotka olivat jo saaneet viisi vuotta tamoksifeenin adjuvanttihoitoa. Potilaat saivat letrotsolia 2, 5 mg tai lumelääkettä päivittäin viiden vuoden ajan. Ensisijainen päätetapahtuma oli HUONONEMISKERTOIMET; toissijaiset päätetapahtumat olivat elämänlaatu, laajennettu turvallisuusprofiili ja OS. 5 187 potilaasta 2 593 sai letrotsolia ja 2 594 lumelääkettä; seuranta-ajan mediaani oli 2, 4 vuotta.
alustavassa analyysissä todettiin 207 paikallista tai metastasoitunutta rintasyövän uusiutumista tai KLBC: n alkuperäisiä maligniteetteja, 75 letrotsoliryhmässä ja 132 lumelääkeryhmässä. Ennustettu neljän vuoden DFS ratesÜ näille kahdelle ryhmälle oli 93% ja 87% (P ?.001 HUONONEMISKERTOIMIEN arviointi). LETROTSOLIHAARASSA DFS: n HR oli 0, 61 (95% CI, P ?.001). Letrotsolilla todettiin 43%: n väheneminen rintasyövän ilmaantuvuudessa (HR 0, 57 , 95%: n luottamusväli, P =.00008).4 lukuun ottamatta solmupositiivisia potilaita (P =.04), OS ei saavuttanut tilastollista merkitsevyyttä (HR 0.82, P =.30).Letrotsolihaarassa 4 potilaalla esiintyi heikkolaatuisia vasomotorisia oireita, lihaskipua ja niveltulehdusta. Osteoporoosi oli yleisempi (joskaan ei merkitsevästi) letrotsoliryhmässä kuin lumelääkeryhmässä (5, 8% vs. 4, 5%; P =.07), ja murtumat olivat vertailukelpoisia käsivarsien välillä. Tutkimus lopetettiin 2, 4 vuoden mediaanin jälkeen letrotsoliryhmän rintasyöpätapahtumien vähenemisen vuoksi. Pidennetty letrotsolihoito viiden vuoden tamoksifeenihoidon jälkeen paransi DFS: ää.
BIG 1-987,9,18: The Breast International Group (BIG) 1-98-tutkimus, kaksoissokkoutettu, satunnaistettu monikeskustutkimus, otti mukaan 8 028 postmenopausaalista naista, joilla oli HR+ varhaisen vaiheen rintasyöpä. Tutkimuksessa oli neljä hoitohaaraa, joissa arvioitiin viiden vuoden tamoksifeenimonoterapiaa, viiden vuoden letrotsolimonoterapiaa, kahden vuoden ajan tamoksifeenia, sitten letrotsoliin siirtymistä kolmeksi vuodeksi tai letrotsoliin siirtymistä kahdeksi vuodeksi ja sitten tamoksifeeniin siirtymistä kolmeksi vuodeksi. Ensisijainen tavoite oli DFS; toissijaisia tavoitteita olivat aika etäpesäkkeisiin, turvallisuus ja OS. DFS lisääntyi letrotsolia saaneilla potilailla verrattuna tamoksifeenia saaneisiin potilaisiin (HR 0, 81 , 95% luottamusväli, suhteellinen väheneminen 19%, P =.003), jonka absoluuttinen ero on 1,5% kolmen vuoden kohdalla. Tamoksifeeni lisäsi tromboembolisten tapahtumien esiintymistä letrotsolihoitoon verrattuna (tai 0, 38, P <.0001). Luunmurtumat lisääntyivät letrotsolihaarassa (tai 1, 44, P =.006).
IES14, 19: IES (Intergroup Exemestane Study) oli satunnaistettu, kaksoissokkoutettu vaiheen III monikeskustutkimus, jonka tavoitteena oli selvittää, oliko eksemestaaniin vaihtaminen kahden-kolmen vuoden tamoksifeenihoidon jälkeen tehokkaampaa kuin tamoksifeenin jatkaminen viiden vuoden ajan. Tutkimukseen otettiin 4 742 postmenopausaalista naista, jotka satunnaistettiin kahteen hoitohaaraan; 2 362 koehenkilön oli määrä siirtyä exemestane 25 mg po qd-hoitoon kahden-kolmen vuoden tamoksifeeniannoksen 20 mg po qd jälkeen viiden vuoden hoidon loppuun saattamiseksi, ja loput 2 380 koehenkilöä saivat 20 mg tamoksifeenia viiden vuoden ajan. Ensisijainen päätetapahtuma oli DFS, toissijaiset päätetapahtumat olivat OS, laajennettu toksisuusprofiili ja KLBC: n esiintymistiheys.
haittavaikutukset, joita esiintyi keskimäärin 30, 6 kuukauden ajan, sisälsivät KLBC: n esiintymistiheyden, paikallisen tai metastaattisen uusiutumisen ja kuoleman. Tapahtumia oli 449–183 eksemestaanihaarassa ja 266 tamoksifeenihaarassa. Eksemestaaniryhmän säätelemätön HR oli 0, 68 (95% CI , P <.001 log-rank-testin perusteella), joka osoitti 32%: n riskin pienenevän ja vastasi HUONONEMISKERTOIMEN etua 4.75 (95% CI) kolmen vuoden kohdalla. Kolmen vuoden kuluttua EKSEMESTAANIRYHMÄN DFS oli 91, 5% (95% CI ) ja tamoksifeeniryhmän 86, 8% (95% CI). Näiden kahden ryhmän välillä ei ollut merkittävää eroa OS: ssa, sillä eksemestaanihaarassa kuoli 93 ja tamoksifeenihaarassa 106 ihmistä. CLBC: n esiintymistiheydessä oli merkittävä ero (P =.04) — 20 koehenkilöä tamoksifeenihaarassa ja yhdeksän koehenkilöä eksemestaanihaarassa. Eksemestaanin käyttö viiden vuoden hoidon loppuun saattamiseksi kahden-kolmen vuoden tamoksifeenihoidon jälkeen paransi DFS: ää verrattuna viiden vuoden tamoksifeenihoitoon.
luukadon estäminen TEKOÄLYTERAPIASTA20
postmenopausaalisilla naisilla on taipumusta vähentää BMD: tä alentuneen estrogeenipitoisuuden vuoksi. Postmenopausaalisen rintasyöpäpotilaan LINTUINFLUENSSAHOITO pahentaa tätä taipumusta. Denosumabi, täysin ihmisen monoklonaalinen vasta-aine, sitoo ydintekijä KB ligandin (RANKL) reseptorin aktivoijaa ja estää RANKL-aktiivisuutta. RANKL on elintärkeä osteoklastien toiminnalle, mikä tarkoittaa luun hajoamista. Denosumabin ja risedronaatin, bisfosfonaatin, kykyä torjua LINTUINFLUENSSAHOITOON liittyvää luukatoa arvioidaan.
Denosumabitutkimus 20: satunnaistetussa faasin III monikeskustutkimuksessa arvioitiin denosumabin käyttöä ihon alle annettuna 60 mg kerran kuudessa kuukaudessa postmenopausaalisilla naisilla, jotka saivat AIS: ää HR: n ja ei-metastaattisen rintasyövän hoitoon. Tavoitteena oli arvioida lannerangan BMD: n muutosta lähtötasosta 12 kuukauteen. 252 potilaasta 127 sai denosumabia ja 125 lumelääkettä. Molemmat haarat saivat kalsiumia ja D-vitamiinia.BMD arvioitiin kaksienergisella röntgenabsorptiometrialla. 12 kuukauden denosumabihoidon ja 24 kuukauden lumelääkkeen jälkeen lannerangan alueen luun mineraalitiheyden suureneminen oli 5, 5% ja 7, 6% denosumabiryhmän eduksi (p <.0001 molempina kuukausina). Denosumabilla oli samankaltainen toksisuusprofiili kuin lumelääkkeellä. Yli 24 kuukautta kestänyttä denosumabihoitoa ei ole vielä arvioitu.
IBIS-II luun Osa21: International Breast Cancer Intervention Study-II (IBIS-II) Bone-Alatutkimus oli johdettu IBIS-II: sta, jossa arvioitiin postmenopausaalisia naisia, joilla oli suurempi todennäköisyys sairastua rintasyöpään ja jotka satunnaistettiin saamaan anastrotsolia tai lumelääkettä viiden vuoden ajan. Alatutkimuksessa, johon osallistui tällä hetkellä 700 potilasta, arvioitiin risedronaattia lumelääkkeeseen verrattuna BMD: n häviämisen ehkäisemiseksi naisilla, joiden t-pisteet olivat lähtötilanteessa alhaiset. Osalle IBIS-II-tutkimuksen potilaista annettiin yksi kolmesta eri hoitostrategiasta alatutkimuksessa. Vuoden kestäneen hoidon jälkeen Ibis-II-hoitoa saaneista 350 anastrotsoli-ja 350 lumelääkettä saaneista potilaista sai osatutkimuksen tulokset. Stratum 1 koostui 227: stä anastrotsolia saaneesta potilaasta, joilla oli normaalit t-pisteet (T-score ?1), stratum 2 koostui 80 potilaat osteopenia (ñ2.5 ? T-score <1), joille annettiin risedronaattia 35 mg kerran viikossa tai lumelääkettä, ja stratumiin 3 kuului 43 osteoporoosipotilasta (ñ4 <T-score <2, 5), joille annettiin risedronaattia 35 mg kerran viikossa.
potilailla, joilla oli osteopenia tai osteoporoosi lähtötilanteessa, risedronaatti näytti estävän anastrotsoliin liittyvää luukatoa. Risedronaatti vaikutti suotuisasti luun mineraalitiheyden säilymiseen koko lonkassa mutta ei lannerangan alueella (P=.005 ja P =.15, vs. lumelääke). Risedronaattiin ei liittynyt vakavia haittavaikutuksia tai yhteisvaikutuksia lääkkeiden kanssa.
AIS-tutkimus premenopausaalisilla naisilla (SOFT)21-26
noin 33%: lla alle 50-vuotiaista naisista todetaan invasiivinen rintasyöpä. 22 The Suppression of Ovarian Function Trial (SOFT, IBCSG 24-02, BIG 2-02) tutkii AI-hoidon käyttöä premenopausaalisilla naisilla, joilla on HR+ rintasyöpä. Tutkimukseen, johon on kohdennettu 3 000 potilaan ilmoittautuminen, osallistuu premenopausaalisia naisia, joilla on HR+ rintasyöpä, jotka ovat suorittaneet kemoterapiaa tai jotka ovat saaneet vain leikkauksen. Munasarjojen ablaatio on perustettu antamalla triptoreliinia (gonadotropiinia vapauttava hormoni) kerran kuukaudessa viiden vuoden ajan, kirurginen ooforektomia, tai lantion säteilytys. Potilaat satunnaistetaan yhteen kolmesta tutkimushaarasta: ensimmäinen ryhmä sai tamoksifeenia kerran päivässä viiden vuoden ajan, toinen ryhmä sai tamoksifeenia viiden vuoden ajan yhdessä munasarja-ablaation kanssa ja kolmas ryhmä sai eksemestaania viiden vuoden ajan yhdessä munasarja-ablaation kanssa. Potilaat saavat eksemestaania tai tamoksifeenia viiden vuoden ajan.
Chemoprevention Trials23-27
tamoksifeeni on tarkoitettu rintasyövän kemopreventioon.6 Sen myrkyllisyysprofiili aiheuttaa rajoituksia terapeuttisessa käytössä.AIs saattaa vähentää HR+ – rintasyövän esiintyvyyttä korkean riskin potilailla, koska KLBC: n esiintyvyys on vähentynyt tamoksifeeniin verrattuna kliinisissä tutkimuksissa, kuten Atac: ssa.6
AI kemopreventiotutkimuksiin kuuluu Kansainvälisen Rintasyöpätutkimusryhmän (IBCSG) tutkimus 31-03 (IBCSG 31-03) ja Kanadan kansallisen syöpäinstituutin kartta.3 oikeudenkäynti. Kansainvälisen, satunnaistetun, lumekontrolloidun IBCSG 31-03-monikeskustutkimuksen ensisijainen tavoite on arvioida anastrotsolin käyttöä rintasyövän ehkäisyyn postmenopausaalisilla naisilla. Sen ensisijainen mittaustulos on invasiivisen ja ei-invasiivisen rintasyövän ilmaantuvuus; toissijainen mittaustulos on osteoporoosin ja murtumien ilmaantuvuus.5 IBCSG 31-03-kokeiluun on tarkoitus ilmoittautua 6 000. kartta.3 tutkimuksessa arvioidaan eksemestaania kemopreventiivisenä aineena postmenopausaalisilla naisilla. Lumekontrolloidun kartan ensisijainen tavoite.3 tutkimuksessa arvioidaan eksemestaanin tehokkuutta invasiivisen rintasyövän esiintyvyyden vähentämisessä.
mahdolliset tulevat käyttötarkoitukset: Tapausraportit
letrotsolia käytettiin sen jälkeen, kun klomifeeni ei ollut onnistunut indusoimaan hedelmällisyyttä 22 naisella, joilla oli munasarjojen monirakkulatauti. Letrotsoli indusoi ovulaation 75%: ssa sykleistä ja 44, 4%: ssa klomifeenin indusoimista sykleistä. Letrotsolin aiheuttamat ovulaatiot johtivat neljään raskauteen, eikä letrotsoliin liittynyt merkittäviä haittavaikutuksia.28, 29
57-vuotias ylipainoinen nainen, jolla oli kohdunpoiston ja molemminpuolisen salpingo-ooforektomian jälkeinen endometrioosi, sai anastrotsolia megestrolihoidon jälkeen. Potilaalla ei ollut kohdun limakalvon leesioita yhdeksän kuukauden kuluttua.28, 30
McCune-Albrightin oireyhtymää sairastavalle potilaalle annettiin anastrotsolia ennenaikaisen murrosiän hoitoon; potilaan estradioli normalisoitui 2, 5 vuoden anastrotsolihoidon jälkeen ja luuikä eteni kuudella kuukaudella.28,31 lisääntynyt estrogeeni voi aiheuttaa gynekomastiaa ja hypogonadotrooppista hypogonadismia.28,31 estrogeenin vähentäminen tekoälyllä johti normaaliin gonadotropiiniin ja testosteroniin miehillä, joilla on gynekomastia ja hypogonadotrooppinen hypogonadismi. 28, 31, 32
letrotsolia tutkittiin relapsoitunutta munasarjasyöpää sairastavilla potilailla; letrotsolia saaneilla potilailla tauti oli stabiloitunut.28,33 Neoadjuvanttia letrotsolia annettiin 10 postmenopausaaliselle naiselle, joilla oli kohdun limakalvon syöpä; lääke osoitti rakentavia kliinisiä muutoksia eikä sillä ollut negatiivista kirurgista vaikutusta.28, 34
kun testolaktonihoitoa verrattiin anastrotsolihoitoon hedelmättömillä miehillä, näiden kahden lääkkeen teho oli sama.2835 Klinefelterin oireyhtymää sairastavaa potilasta sai tehokkaampaa hoitoa testolaktonilla kuin anastrotsolilla.28, 35
päätelmät
kolmannen sukupolven AIs: ssä on todettu parempi DFS postmenopausaalisilla naisilla, joilla on HR+ rintasyöpä, mutta kliinistä hyötyä yli viiden vuoden LINTUINFLUENSSAHOIDOSTA näillä potilailla ei ole osoitettu.4 National Surgical Adjuvant Breast and Bowel Project (NSABP) B-33 (exemestane) – tutkimus ja sen jälkeinen MA: n satunnaistaminen.17 (letrotsoli) – tutkimuksessa tarkastellaan näiden AIs: n käyttöä lumelääkkeeseen verrattuna vielä viiden vuoden ajan.AIs on sopiva vaihtoehto hormonikorvaushoitoon ja postmenopausaalisille naisille, joille tamoksifeeni on vasta-aiheinen.4
kolmannen sukupolven AIs: n suotuisia vaikutuksia ovat siedettävämpi toksisuusprofiili ja parempi HUONONEMISKERROIN verrattuna tamoksifeeniin. Näiden lääkeaineiden ja tamoksifeenin välinen tehotaso on vertailukelpoinen. Hoidon kestosta, pitkän aikavälin toksisuusprofiilista ja AIs: n asianmukaisesta antojärjestyksestä ei ole vielä varmuutta.4 uusia tutkimuksia tarvitaan tuottamaan selektiivisiä aromataasi modulaattoreita, jotka tuottavat vähemmän toksisuutta kuin AIs.25,36-37
1. Robertson JFR. Fulvestrantti (FaslodexÆ) – miten tehdä hyvä lääke paremmin. Onkologi . 2007;12:774-784.
2. Osborne CK. Lääkehoito: tamoksifeeni rintasyövän hoidossa. N Engl J Med. 1998;339:1609-1618.
3. National Cancer Comprehensive Network. NCCN clinical practice guidelines in oncology — v. 1. 2008. Rintasyöpä. www.nccn.org/professionals/physician_gls/f_guidelines.asp. Accessed 11 lokakuu 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Onkol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Hormoniperäisten syöpien ehkäisy: rintasyöpä. J Clin Onkol. 2005;23:357-367.
6. Smith eli Dowsett M. aromataasin estäjät rintasyövässä. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Aromataasi-inhibiittorit rintasyövän hoidossa ja ehkäisyssä. J Clin Onkol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, toim. Drug Information Handbook. 13. Hudson, OH: Lexi-Comp; 2005: 117,598,871.
9. Ellis MJ, toim. Aromataasi-inhibiittorit rintasyövän hoitoon. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (anastrotsoli) pakkausseloste. Wilmington, DE: AstraZeneca Pharmaceuticals LP; toukokuu 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&show=dept&article_id=9884. Accessed 17 Maaliskuu 2008.
14. Aromasin (exemestane) pakkausseloste. Helmikuuta 2007.
15. Baum M, Budzar AU, Cuzick J, et al, Atac: n Trialistien ryhmälle. Anastrotsoli yksinään tai yhdessä tamoksifeenin kanssa verrattuna pelkkään tamoksifeeniin adjuvanttihoidossa postmenopausaalisilla naisilla, joilla on varhainen rintasyöpä: ensimmäiset tulokset Atac-satunnaistetusta tutkimuksesta. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum m, et al, Atac-Trialistien ryhmälle. Tulokset Atac (Arimidex, tamoksifeeni, yksin tai yhdistelmähoitona) tutkimuksen päätyttyä 5 vuoden liitännäishoito rintasyövän. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino s, et al. Satunnaistetussa letrotsolitutkimuksessa postmenopausaalisilla naisilla, jotka olivat saaneet tamoksifeenia viisi vuotta varhaisvaiheen rintasyövän hoidossa. N Engl J Med. 2003;349:1793-1802.
18. Thrimann B, Keshaviah A, Coates AS, et al, for the Breast International Group (BIG) 1-98 Collaborative Group. Letrotsolin ja tamoksifeenin vertailu postmenopausaalisilla naisilla, joilla oli varhainen rintasyöpä. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson Lj, et al, for the Intergroup Exemestane Study. Satunnaistettu eksemestaanitutkimus kahden-kolmen vuoden tamoksifeenihoidon jälkeen postmenopausaalisilla naisilla, joilla oli primaarinen rintasyöpä. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Vaiheen 3 tutkimus denosumabihoidon vaikutuksesta luun mineraalitiheyteen naisilla, jotka saivat aromataasi-inhibiittoreita ei-metastasoituneen rintasyövän hoitoon. Paperi esitetty: the 30th Annual San Antonio Breast Cancer Symposium; Joulukuu 13-16, 2007; San Antonio, TX. Abstrakti 47.
21. Singh S, Cuzick J, Edwards R, et al. Anastrotsolin vaikutus luun mineraalitiheyteen vuoden hoidon jälkeen: tulokset kansainvälisen Rintasyöpäinterventiotutkimuksen (IBIS-II) luualatutkimuksesta. Paperi esitetty osoitteessa: the 30th Annual San Antonio Breast Cancer Symposium; 13. -16. joulukuuta 2007; San Antonio, TX. Abstrakti 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. adjuvant endocrine therapy for premenopausal women with early breast cancer. J Clin Onkol. 2005;23:1736-1750.
23. National Cancer Institute. Rintasyövän hoito (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. Accessed 26 joulukuu 2007.
24. Baylor College of Medicine Clinical Trials. Munasarjojen toimintakokeiden suppressio (SOFT). www.breastcenter.tmc.edu/clinic/trials/soft.htm. Accessed 26 joulukuu 2007.
25. Aebi S, Castiglione-Gertsch M. adjuvantti endokriininen hoito hyvin nuorille potilaille. Rinta. 2003;12:509-515.
26. ClinicalTrials.gov. munasarjojen toiminnan tukahduttaminen sekä tamoksifeeni tai eksemestaani verrattuna pelkkään tamoksifeeniin hoidettaessa premenopausaalisia naisia, joilla on hormoneihin reagoiva rintasyöpä. www.clinicaltrials.gov/. Accessed 26. joulukuuta 2007.
27. Cuzick J. Aromataasi-inhibiittorit rintasyövän ehkäisyyn. J Clin Onkol. 2005;23:1636-1643.
28. Karaer O, OruÁ s, Koyuncu FM. Aromataasi-inhibiittorit: mahdolliset tulevat sovellukset. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Aromataasi-inhibiittorin käyttö ovulaation indusointiin potilailla, joilla ei ole riittävää vastetta klomifeenisitraatille. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Aromataasin rooli endometriumin taudissa. J Steroidi Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Aromataasi-inhibiittorien käyttö varhaiskypsässä murrosiässä. Endocr Liittyy Syöpään. 1999;6:303-306.
32. Shozu M, Sebastian s, Takayama k, et al. Estrogeeniylimäärä, joka liittyy aromataasigeeniin vaikuttaviin uusiin gain-of-function mutaatioihin. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, et al. CA 125-vaste liittyy estrogeenireseptoriekspressioon faasin II tutkimuksessa letrotsolilla munasarjasyövässä: umpieritysherkän alaryhmän tunnistaminen. Clin Cancer Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld e, et al. Endometriumsyövän neoadjuvanttihoito aromataasi-inhibiittorilla letrotsolilla: endokriiniset ja kliiniset vaikutukset. Eur J Obstet Gynekomastia Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Aromataasi-inhibiittorit miesten hedelmättömyyteen. Jurol. 2002;167:624-629.
36. Simpson ER, Dowsett M. aromataasi ja sen estäjät: merkitys rintasyövän hoidossa. Recent Prog Horm Res. 2002; 57: 317-338.