Delokalisaatio tapahtuu, kun sähkövaraus jakautuu useammalle kuin yhdelle atomille. Esimerkiksi sidoselektronit voivat jakautua useiden yhteen sitoutuneiden atomien kesken.

Esimerkki 1:
yksi tunnetuimmista esimerkeistä molekyylistä, jossa sidoselektronit delokalisoituvat, on bentseeni, alla esitetty:
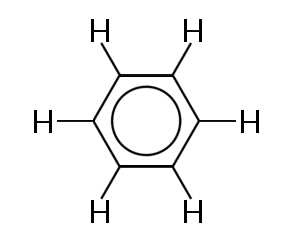
bentseeni koostuu kuuden hiiliatomin renkaasta. Hiiliatomit ovat kaikki sp2-hybridisoituneita yhden hybridoimattoman p-orbitaalin kanssa.
SP2-hybridiorbitaalit tuottavat normaaleja kovalenttisia sidoksia, joita joskus kutsutaan σ-sidoksiksi: näitä ovat yksittäiset C-C-sidokset ja yksittäiset C-H-sidokset.
tällöin jokaiselle hiilelle jää elektroni P-orbitaalilla suorassa kulmassa renkaan tasoon nähden.
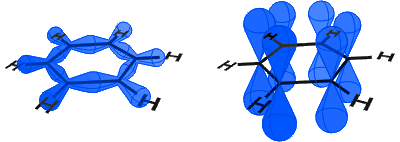
alla olevassa kaaviossa vasemmalla näkyy SP2-orbitaalit, jotka muodostavat kovalenttisia sidoksia. Oikealla näet p-orbitaalit, joista jokainen sisältää elektronin.
p-orbitaalit yhdistyvät puoli on ja p-orbitaalien elektronit kuvataan π-elektroneiksi.
alla olevassa kaaviossa p-orbitaalit ovat yhdistyneet ja π-elektronit delokalisoituneet. Keskimäärin kaikki rengassidokset ovat identtisiä.
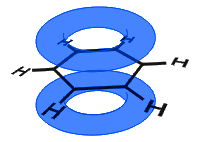
toisin kuin seuraavassa esimerkissä alla, bentseenin delokalisoituneet elektronit ovat molekyylin sisällä eivätkä pääse vapaasti liikkumaan irtomateriaalin läpi.
Esimerkki 2:
metalleilla on korkea lämmön-ja sähkönjohtavuus, koska niiden atomien uloimmat elektronit delokalisoituvat. Nämä elektronit eivät liity mihinkään tiettyyn metalliytimeen, joten ne voivat liikkua vapaasti koko metallin alueella.
kuittaus: bentseenin orbitaalien sinisävyiset kuvat ovat sansculotten luvalla. Nämä kuvat on lisensoitu Creative Commons Attribution-Share Alike 1.0-lisenssillä.