hyvä lähtökohta ionin elektronikonfiguraatiolle on neutraalin atomin elektronikonfiguraatio.
sinun tapauksessasi täytyy löytää fluorianionin elektronikonfiguraatio #”F”^ ( -)#, joten aloita kirjoittamalla neutraalin fluoriatomin elektronikonfiguraatio #”F”#.
fluori sijaitsee jaksollisen järjestelmän periodissa 2, ryhmässä 17 ja sen järjestysluku on #9#. Tämä kertoo, että neutraalilla fluoriatomilla on yhteensä #9# elektroneja, jotka ympäröivät sen ydintä.
sen elektronikonfiguraatio on
#”F:” 1s^2s^2 2p^5#
nyt muodostuu #”F”^(-)# anioni, kun #1# elektroni lisätään neutraaliin fluoriatomiin.
huomaa, että neutraalin atomin 2P-alikuori sisältää #5# elektroneja. Sen maksimikapasiteetti on todellisuudessa #6# elektroneja, kaksi elektronia jokaista p-orbitaalia kohti.
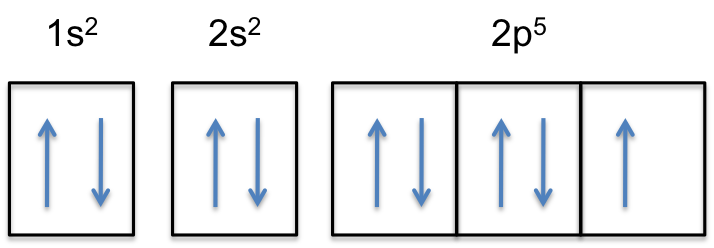
tämä tarkoittaa, että #väri(punainen)(”ylimääräinen elektroni”)# lisätään yhteen kolmesta 2p-orbitaalista, sanotaan #2p_y#.
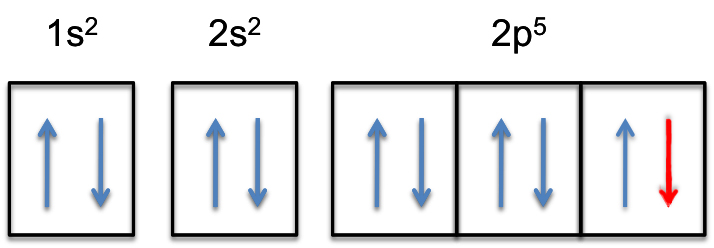
2p-alikuori täyttyy nyt kokonaan, eli sillä on #6# elektroneja.
fluorianionin elektronikonfiguraatio on siis
#Väri(Vihreä) (/bar (ul (Väri (Valkoinen) (A / a) Väri (Musta) (”F”^( -):Väri(Valkoinen)(a) 1s^2color(Valkoinen)(a) 2s^2 color(valkoinen)(A)2p^6)color(valkoinen)(a/A)|))#
huomaa, että fluoridianionilla on yhteensä #8# elektroneja sen toisessa kuoressa, uloimmassa kuoressa. Tämä kertoo, että anionilla on täydellinen oktetti.
koska fluorianioni on isoelektroninen neonin kanssa, #”Ne”#, sen elektronikonfiguraation voi kirjoittaa jalokaasun pikakirjoituksella seuraavasti:
#
täällä
## – elektronikonfiguraatio Neon