mikä on solun redox-potentiaali?
Reader Mode
Redox-potentiaaleja käytetään kuvaamaan elektroninsiirtoon liittyvien reaktioiden vapaata energiakustannusta ja suuntaa, joka on yksi biokemiallisista reaktioista kaikkein näkyvimpiä ja tärkeimpiä. Tällaisille pelkistys-hapetusreaktioille on ominaista vapaa energiamuutos, joka jakaa joitakin käsitteellisiä piirteitä sen kanssa, jota käytetään kuvaamaan PKA: ta happo-emäsreaktioissa, joissa on kyse protoninsiirrosta elektroninsiirron sijaan. Tässä vinjetti, yksi Abstrakti kirja, keskustelemme siitä, miten redox potentiaali voidaan käyttää mittana käyttövoima tietyn hapetus-pelkistysreaktio kiinnostaa. Toisin kuin pH, ei ole mitään järkeä, jossa yksi voi määrittää yhden redox potentiaali koko solun.
yhdisteen redox-potentiaali eli oikeammin pelkistyspotentiaali viittaa sen taipumukseen hankkia elektroneja ja siten pelkistyä. Jotkut lukijat saattavat muistaa muistikuvan ”OILRIG”, joka muistuttaa, että” hapettuminen on menetys, pelkistyminen on voitto”, jossa menetys ja voitto ovat elektroneja. Tarkastellaan reaktiota, johon liittyy elektroninsiirto: Aox + ne– ↔ Ared, jossa n elektronit ottavat vastaan hapettuneen muodon (Aox), jolloin yhdisteestä a saadaan pelkistynyt muoto (Ared). Elektronin luovuttajan ja hyväksyjän välinen redox-potentiaaliero ΔE liittyy reaktioon liittyvään vapaan energian muutokseen ΔG via ΔG=NFΔE, jossa n on siirrettyjen elektronien lukumäärä ja F on Faradayn vakio (96,485 J/mol/V tai ≈100 kJ/mol/v). Tarkastelemalla näiden potentiaalien taulukoituja arvoja on mahdollista kehittää intuitio elektroninsiirtotaipumukselle ja siten reaktion suunnalle.

kuva 1: ”redox-torni”, joka osoittaa yhteisten metabolisten puolireaktioiden redox-potentiaalin. Aineenvaihduntaprosessit voidaan nähdä elektronien siirtymisenä molekyylien välillä, jolloin elektronit usein kaappaavat osan vapautuvasta energiasta siirryttäessä suuresta energiasta matalampiin energiatiloihin kuten glykolyysissä tai hengityksessä. Päällä olevien ”puolireaktioiden” luovuttamia elektroneja voidaan kuluttaa puolireaktiossa alempana tornissa termodynaamisesti suotuisan reaktion loppuun saattamiseksi. Esimerkiksi glykolyysin nettoprosessissa glukoosi hapettuu pyruvaatiksi, jolloin nad+ pelkistyy NADH: ksi. Koska glukoosin hapettuminen sijaitsee tornin huipulla ja NAD+: n pelkistyminen on sen alapuolella, tämä elektronivirta on termodynaamisesti suotuisa. Vertaamalla ATP: n hydrolyysiasteikkoon voimme myös nähdä, että tämä elektronivirta on riittävän suotuisa ATP: n tuottamiseksi. Aerobiseen hengitykseen liittyy monia välivaiheen elektroninsiirtoja elektroninsiirtoketjun kautta. Useita näistä siirtymistä on esitetty, mukaan lukien hapettumissukkinaatti fumaraatiksi, joka on mekanistisesti kytketty ubikinonin pelkistymiseen ubikinoliksi sisemmissä mitokrondriaalikalvoissa. Jokaisen näistä välivaiheen elektroninsiirroista on oltava termodynaamisesti suotuisa yksinään, jotta hengitys voi edetä. Vertaamalla ”ATP: n hydrolyysiasteikkoon” voimme nähdä, että elektroninsiirtoketjun yksittäiset muunnokset eivät ole tarpeeksi energisiä tuottamaan ATP: tä yksinään. Silti ne ovat niin suotuisia, että ne pumppaavat protonin solun tai mitokondrioiden kalvon poikki. Tämä on kemiosmoosin energinen perusta: solut varastoivat Quantan energian liian pieneksi ATP-synteesiin protonigradientissa kalvon poikki. Tätä energiaa käytetään myöhemmin ATP: n tuottamiseen muuntamalla H+ – gradientti ATP: n fosfoanhydridisidoksiksi ATP-syntaasin kautta.
vaikka ATP: tä usein väitetään solun energiavaluutaksi, itse asiassa solun energeettiselle tasapainolle pelkistävän voiman kantajat eivät itse ole yhtä tärkeitä. Tärkein esimerkki näistä kantajista on molekyyli NADH pelkistetyissä tai hapettuneissa (NAD+) muodoissaan. Redox-potentiaalin avulla voidaan yhdistää nämä kaksi molekylaarista protagonistia ja arvioida yläraja niiden ATP-molekyylien lukumäärälle, joita voidaan tuottaa NADH: n hapettumisesta (tuotettu esimerkiksi TCA-syklissä). Nad+ / NADH-parin redox-potentiaali on E = -0,32 V ja se hapetetaan hapen avulla antamaan vettä (väliaineesta tulevat protonit), jonka redox-potentiaali on E = +0,82 V. molemmat esitetään kuvassa 1 osana keskeisten biologisten puolireaktioiden ”redox-tornia”, joka voidaan yhdistää redox-potentiaalin kokonaismuutoksen ja siten vapaan energian löytämiseksi. Edellä tarkastellussa reaktiossa NADH: n hapetus hapen avulla maksimaalinen siihen liittyvä vapaa energia, joka voidaan uuttaa, on näin
ΔG = n X F x ΔE = 2 x 100 kj/(molxV) x (0,82-(-0,32)) V = 230 kJ/mol≈ 90 kBT,
missä N=2 ja f≈100kj/mol/V. ATP: n hydrolyysissä vapaa energiamuutos on ≈50kj/mol fysiologisissa olosuhteissa huomaamme, että 228 kJ/mol riittää tuottamaan maksimissaan 228/50≈4,5 atps. Solussa NADH: n hapettuminen etenee useiden vaiheiden kautta hengityksessä ja johtaa 10 protonin siirtymiseen kalvon poikki sähkökemiallista potentiaalia vastaan (BNID 101773). Nämä protonisiirrot vastaavat vielä yhtä tapaa kaapata biokemiallista energiaa. ATPaasi käyttää tämän energian 2-3 ATPs: n tuottamiseen. Näin ollen noin puolet siitä energiasta, joka vapautui elektronien siirtyessä NADH: sta Happeen, säilyy ATP: ssä. Sen varmistaminen, että reaktio etenee suunnatusti tuottaakseen ATP: tä sen sijaan, että kuluttaisi sitä, vaatii, että osa energiasta ”menee hukkaan”, koska systeemin on oltava epätasapainossa.
miksi pitäisi keskustella puolireaktioiden redox-potentiaaleista eikä täyden reaktion vapaista energioista? Yksiköt ovat itse saaneet alkunsa sähkökemian alalla kyvystä mitata laboratoriossa jännite-eroa eli voltteina mitattua potentiaalia kahden eri elektronikantajia sisältävän kammion välillä ja pysäyttää nettoreaktio jännitteellä. Redox-potentiaalien hyödyllisyys puolireaktioissa piilee kyvyssä koota eri luovuttajien ja hyväksyjien yhdistelmiä, joiden avulla voidaan arvioida jokaisen harkitun reaktion termodynaamista toteutettavuutta ja energiavoittoa. Jos on K mahdolliset elektroninsiirtoyhdisteet, ~k2 mahdolliset reaktiot voidaan ennustaa vain K redox-potentiaalien perusteella.
aivan kuten puhumme liuoksen pH: sta, voisimme ensi arvailulla kuvitella, että olisi mahdollista puhua solun näennäisesti analogisesta redox-potentiaalista. Tietämällä tietyn reaktioparin pelkistyneiden ja hapettuneiden muotojen konsentraatio määrittää niiden poolisen redox-potentiaalin relaation kautta
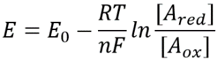
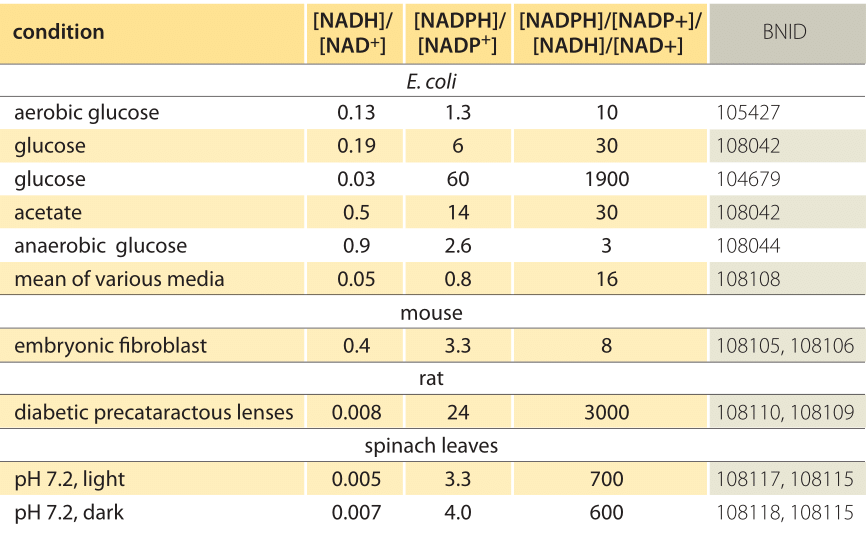
Taulukko 1: yhteisten elektroninantajaparien nad/NADH ja NADP/NADPH. Kuten voidaan nähdä ensimmäinen on suhteellisen hapettunut ja toinen suhteellisen pelkistynyt suhde niiden joukossa yleensä paljon suurempi kuin 1.
tämä yhtälö (niin sanottu Nernst-yhtälö) antaa redox-potentiaalin arvon solulle tyypillisissä konsentraatio-olosuhteissa verrattuna standarditilaolosuhteisiin (missä definition =). Esimerkkinä voidaan pitää elektronin luovuttamista NAD+: lle, jolloin syntyy hapettunut muoto NADH. Mitokondrio-matriisissa on ilmoitettu 10-kertainen suhde hapettuneeseen muotoon (BNID 100779), kuten on esitetty taulukossa 1. Tällöin huomaamme, että tekijä on ≈30 mV ja siten redox-potentiaali muuttuu -0.32 V: stä -0.29 V: een. Varmista suuntaan vaikutus saimme on järkevää huomaamme, että ylitarjonta hapettuneen muodon taipumus hapettaa happea on hieman pienempi, kuten nähdään se, että redox potentiaali on nyt lähempänä kuin ennen kuin happi/vesi electron vaihto pari (+0,82 V).
solu ei ole tasapainotilassa ja eri redox-parien välinen kytkentä on heikko. Tämä tilanne johtaa erilaisten redox-potentiaalien perustamiseen solussa samanaikaisesti oleville redox-pareille. Jos redox–parin, Aredin ja Aox: n sekä toisen jalostetun ja laatikon pelkistettyjen ja hapettuneiden muotojen tuotanto-ja käyttövirrat ovat paljon suurempia kuin niiden interconversion flux, Ared+Box<>AOX+jalostettu, niin A: lla ja B: llä voi olla hyvin erilaiset redox-potentiaalit. Tämän seurauksena on huonosti määritelty kysyä solun yleisestä redox-potentiaalista, koska se on erilainen eri komponenteille solun sisällä. Sitä vastoin solun (tai sen jonkin osaston) pH on paljon paremmin määritelty, koska vesi toimii universaalina väliaineena, joka yhdistää erilaiset happo-emäsreaktiot ja tasapainottaa niin sanotun kaikkien lajien kemiallisen potentiaalin.
tietylle redox-parille tietyssä soluosastossa näiden kahden muodon pitoisuussuhde määrää redox-potentiaalin hyvin määritellyllä tavalla. Elektroneja nopeasti vaihtavat yhdisteet ovat suhteellisessa tasapainossa ja jakavat siten samanlaisen redox-potentiaalin. Nähdäksemme, miten nämä ideat toimivat, on siis hyödyllisintä harkita redox-paria, joka osallistuu moniin keskeisiin solureaktioihin ja jonka seurauksena se liittyy tiukasti monien yhdisteiden redox-tilaan. Sytoplasmassa oleva glutationi on tällainen yhdiste, sillä se osallistuu monien proteiinien kysteiiniaminohappojen hyvin vallitsevien tiolisidosten (rikkiä sisältävien) pelkistämiseen ja hapettamiseen. Glutationi on tripeptidi (koostuu 3 aminohaposta), keskeinen kysteiini, joka voi olla pelkistetyssä (GSH) tai hapettuneessa muodossa, jossa se muodostaa dimeerin kysteiinin kanssa toisesta glutationimolekyylistä (merkitään GSSG). Glutationin puolireaktio on siten 2 x GSH <> GSSG + 2e– + 2h+. Toinen puolireaktio on usein rikkisidos, joka” aukeaa ” vastaanottavassa proteiinissa, jolloin glutationi pysyy pelkistetyssä muodossa jatkuvan toiminnan vuoksi. Glutationi on myös hallitseva toimija neutralisoitaessa reaktiivisia yhdisteitä, joilla on suuri taipumus siepata elektroneja ja siten hapettaa muita molekyylejä. Tällaisia yhdisteitä syntyy oksidatiivisessa stressissä esimerkiksi silloin, kun hengityksen tai fotosynteesin elektroninsiirtoreaktioiden kapasiteetti saavutetaan. Kollektiivisesti kutsutaan ROS (reaktiivinen happi lajit) ne voivat aiheuttaa tuhoa solun ja ovat mukana monissa prosesseissa ikääntymisen. Glutationin kaksoisrooli proteiinien taitossa ja ROS: n rajoittamisessa sekä sen suhteellisen korkea pitoisuus ja elektroninsiirtoreaktiivisuus tekevät siitä solun redox-tilan alkulähteen. Glutationin pitoisuus solussa on ≈10mm (BNID 104679, 104704, 111464), mikä tekee siitä solun toiseksi runsaimman metaboliitin (glutamaatin jälkeen) varmistaen, että sillä on hallitseva rooli elektronin luovuttajana proteiinien toiminnan redox-säätelyssä. Solujen muissa toiminnoissa on muitakin dominoivia elektronipareja. Biosynteettisissä anabolisissa reaktioissa NADP+/NADPH-pari ja hajoamiskatabolisissa reaktioissa se on nad+/NADH.
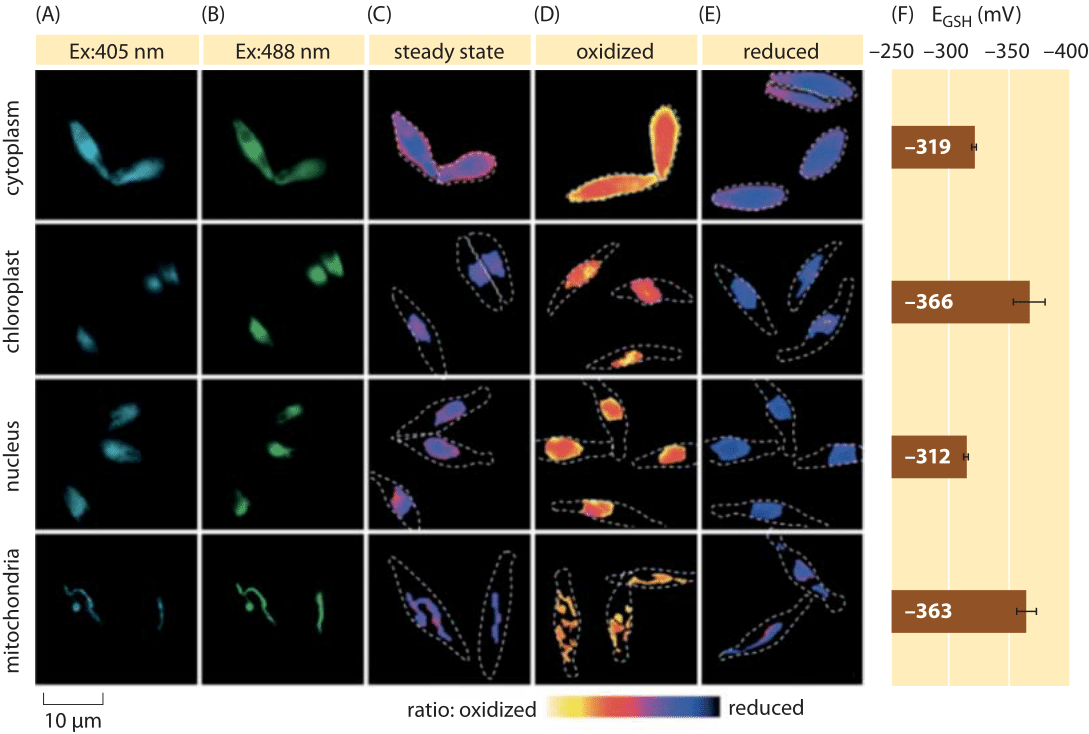
kuva 2: glutationialtaan subsellulaarinen redox-potentiaali piilevissä in vivo. P. tricornutum-solujen fluoresenssimikroskopiakuvaukset, jotka ilmentävät roGFP2: ta eri subsellulaarisissa lokalisaatioissa. Fluoresenssikuvat kahdella magnetoinnin aallonpituudella (A, B) jaettiin ratiometristen arvojen (C) saamiseksi. Kalibrointia varten ratiometriset kuvat otetaan voimakkaissa hapetin – (150 mM H2O2) (D) ja reduktantti – (1 mM DTT) (E) olosuhteissa. Rikotut viivat kuvaavat solujen ääriviivoja, jotka on piirretty kirkkaiden kenttäkuvien perusteella. F) glutationi-poolin vakaan tilan redox-potentiaali, EGSH mV: nä, laskettiin Nernst-yhtälön perusteella käyttäen hapetustasoa annettujen pH-arvojen mukaisesti kullekin organellille. Adapted from: S. Graff van Creveld et al., ISME J., 9: 385, 2015.
miten redox-potentiaalien mittaaminen elävissä soluissa tapahtuu? Vielä yksi loisteproteiinivallankumouksen edunsaaja oli redox-potentiaalien kohde. Reporter GFP suunniteltiin redox-herkäksi lisäämällä kysteiiniaminohappoja, jotka vaikuttavat fluoresenssiin glutationi-poolin pelkistäessä niitä. Kuvassa 2 esitetään tulos, kun tällaista toimittajaa käytetään tarkastelemaan glutationin redox-potentiaalia piilevän eri osastoissa.
glutationialtaan redox-tilan mittauksista eri soluelimissä ja vaihtelevissa olosuhteissa voidaan päätellä pelkistyneiden ja hapettuneiden muotojen pitoisuuksien suhde. Arvot vaihtelevat noin -170 mV ER: ssä ja apoptoottisissa soluissa noin -300 mV: hen useimmissa muissa organelleissa ja proliferaatiosoluissa (BNID 103543, 101823, 111456, 111465). Koska glutationin normaali redox-potentiaali on -240 mV (BNID 111453, 111463), mikä sitten on pelkistetyn ja hapettuneen glutationin suhde? Käyttämällä Nernst-yhtälöä (tai vastaavasti Boltzmannin jakaumasta) tuotteen ja reaktantin suhteen kymmenkertainen muutos vastaa ≈6 kJ/mol: n lisäystä vapaassa energiassa (≈2 kBT). Ottaen huomioon GSH/GSSG-reaktiossa siirretyt 2 elektronia tämä konsentraatiosuhteen muutos on yleensä yhtä suuri kuin 30mv, joskin glutationille 2 GSH-molekyylin sulautuminen yhteen gssg: hen kovalenttisesti sitoutuneena molekyylinä tekee tästä vain approksimaation. 100 mV: n muutos, joka raportoidaan kaikissa olosuhteissa, kuvastaa suunnilleen samansuuruisten redusoituneiden ja hapetettujen muotojen (apoptoottisissa soluissa) pitoisuuksien suhdetta yli 1000 kertaa suurempaan pelkistetyn muodon pitoisuuteen. Itse asiassa useimmissa soluolosuhteissa hapettunut muoto on vain hyvin pieni osa koko poolista, mutta sillä on silti fysiologisia vaikutuksia.
yksi hämmentävä piirre redox-reaktioissa on se, että siirto voi tapahtua useassa muodossa. Yhdessä tapauksessa kyse on vain elektroneista kuten sytokromien elektroninsiirtoketjuissa suorittamissa reaktioissa. Toisessa yleisessä tapauksessa se on elektronien ja protonien yhdistelmä kuten kofaktorissa NAD+ / NADH, jossa kaksi elektronia ja yksi protoni (H+) siirtyvät. Lopuksi on vielä ne reaktiot, joissa sama määrä elektroneja ja protoneja siirtyy, kun luonnollisesti tekisi mieli keskustella vetyjen siirrosta. Näin on esimerkiksi glukoosin hapettumisen kokonaisreaktiossa, jossa happi pelkistyy vedeksi. Kaksi vetyä on siis siirretty, joten pitäisi keskustella elektronien, vetyjen tai protonien siirtymisestä? Redox-potentiaalin määritelmä (annettu edellä) keskittyy vain elektronin ”tilaan”. Entä protonit ja mitä niille tapahtuu, kun törmää elektroninsiirtoreaktioketjuun, jossa jotkin väliyhdisteet sisältävät vetyprotonit ja jotkin eivät? Selitys piilee ympäröivässä vedessä ja niiden pH: ssa.reaktio tapahtuu tietyssä pH: ssa ja reagoivat yhdisteet ovat tasapainossa tämän pH: n kanssa, jolloin protonin irtoamisella tai vastaanottamisella ei ole vaikutusta energetiikkaan. Vesipitoinen väliaine toimii poolina, johon protonit voivat ”parkkeerata”, kun siirtoreaktio on pelkästään elektroneja (analogia lainattu Steven Rosen erittäin helposti saatavilla olevasta biokemian johdantokirjasta” the chemistry of life”). Nämä parkkeeratut protonit voidaan lainata takaisin myöhemmissä vaiheissa, kuten tapahtuu oksidatiivisen hengityksen loppuvaiheessa, jossa sytokromioksidaasi ottaa protoneja väliaineesta. Koska oletetaan, että vettä on kaikkialla, ei tarvitse selittää protoneja, paitsi jos tiedetään vallitseva pH, joka kuvaa taipumusta antaa tai vastaanottaa protoneja. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




