hybridisaatioteoria nähdään usein pitkä ja sekava käsite ja se on kätevä taito pystyä nopeasti määrittää, jos atomi on sp3, sp2 tai sp ilman käydä läpi kaikkia yksityiskohtia siitä, miten hybridisaatio oli tapahtunut.
onneksi tähän on oikotie ja tässä viestissä yritän tiivistää tämän muutamaan erilliseen askeleeseen, joita sinun on noudatettava.
sanotaan, että sinua pyydetään määrittämään hybridisoitumistila seuraavan molekyylin numeroiduille atomeille:

ensimmäinen asia, joka sinun täytyy tehdä, on määrittää kussakin atomissa olevien ryhmien lukumäärä. Ryhmillä tarkoitetaan joko atomeja tai yksinäisiä elektronipareja. Tätä kutsutaan myös Steeriluvuksi (SN).

alla on muutamia esimerkkejä steeriluvuista 2-4, mikä on pitkälti se, mitä orgaanisessa kemiassa tarvitsee tietää:

huomaa, että monisidoksilla ei ole väliä, se on atomit + yksinäiset parit mille tahansa sidostyypille.
kun osaat määrittää steeriluvun (se on VSEPR – teoriasta), sinun tarvitsee vain soveltaa seuraavaa korrelaatiota:
jos steeriluku on 4, se on sp3
jos steeriluku on 3 – sp2
jos steerinen luku on 2-sp
joten nyt palataan molekyyliimme ja määritetään hybridisaatiotilat kaikille atomeille.
C1 – SN = 3 (kolme atomia kytkettynä), joten se on sp2
C2 – SN = 3 (kolme atomia kytkettynä), joten se on sp2
O4 – SN = 3 (1 atomi + 2 yksinäistä paria), joten se on sp2
O5 – SN = 4 (2 atomia + 2 yksinäistä paria), joten se on sp3
C6 – SN = 4 (4 atomia), siis se on SP3
C6 – Sn = 4 (4 atomia), siis se on SP3
C7 – Sn = 4 (4 atomia), joten se on SP3
N8 – Sn = 4 (3 atomia + 1 yksinäinen pari), joten se on SP3
C9 – Sn = 2 (2 atomia), joten se on sp
C10-Sn=2 (2 atomia), joten se on sp

lisäksi tämä menetelmä, se on myös erittäin hyödyllistä muistaa joitakin ominaisuuksia, jotka liittyvät rakenteeseen ja hybridisaatio. Yleensä atomi, jossa on kaikki yksittäiset sidokset, on SP3 hybridisoitunut. Paras esimerkki ovat alkaanit. Kaikki alkaanin hiiliatomit ovat SP3-hybridisoituneita tetraedrisen geometrian kanssa.
alkeenien ja muiden kaksoissidoksen omaavien atomien hiilet ovat usein sp2-hybridisoituneita ja niillä on trigonaalinen planaarinen geometria.
kolmoissidos taas on tyypillinen alkyyneille, joissa hiiliatomit ovat SP-hybridisoituneita.
on olemassa muutamia yleisiä poikkeuksia siitä, mitä olemme keskustelleet hybridisaatiotilan määrittämisestä, ja ne liittyvät lähinnä menetelmään, jossa tarkastellaan atomin sidostyyppiä.
esimerkiksi hiilidioksidissa (CO2) hiilellä on kaksi kaksoissidosta, mutta se on SP-hybridisoitunut.
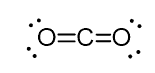
ja syy tähän on se, että hiilen steerinen luku on kaksi (siihen on liittynyt vain kaksi happiatomia) ja pitääkseen kaksi atomia 180o: ssa, mikä on optimaalinen geometria, hiilen on käytettävä kahta identtistä orbitaalia. Tämä on mahdollista vain SP-hybridisaatiossa. Kahta muuta 2P-orbitaalia käytetään hiilen kummallakin puolella olevien kaksoissidosten tekemiseen.
toinen yleinen ja hyvin tärkeä esimerkki ovat karbokationit.

tässä hiilessä on vain yksittäisiä sidoksia ja se voi näyttää siltä, että sen oletetaan olevan sp3 hybridisoitunut. Näiden karbokationityyppien hiili on kuitenkin SP2-hybridisoitunutta. Jälleen samasta syystä, että sen steerinen luku on 3 (sp2 – kolme identtistä orbitaalia).
poikkeuksena Steerilukumenetelmä
yksi poikkeus steeriluvun kanssa on esimerkiksi amidit. Typpiatomilla on tässä steerinen numero 4 ja sen odotetaan olevan sp3. Yksinäisen parin resonanssidelokalisaation vuoksi se kuitenkin interconverts sp3: sta sp2: een, koska se on ainoa tapa ottaa elektronit kohdistetulla P-orbitaalilla, joka voi limittyä ja osallistua resonanssistabilaatioon c=O-kaksoissidoksen pi-sidoselektronien kanssa.

useimmissa tapauksissa poikkeuksista ei tarvitse huolehtia, jos mennään Steeriluvun perusteella.