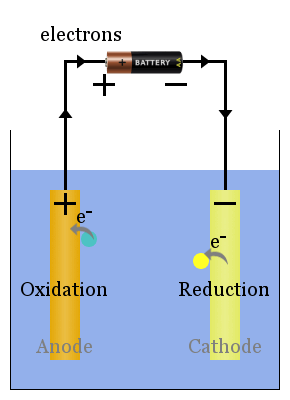
volttikenno, joka usein tunnetaan galvaanisena Soluna, tuottaa sähköenergiaa. Tämän energian lähde on spontaani kemiallinen reaktio, tarkemmin spontaani redox-reaktio.
esimerkiksi kaikki akut on valmistettu yhdestä tai useammasta volttikennosta;akut menevät tyhjiksi, kun suurin osa tai kaikki niiden reaktantit on muutettu tuotteiksi, jolloin niiden kemiallinen potentiaalienergia muuttuu sähköenergiaksi.
Voltaic Cells – the Basic Process
Kemiallinen potentiaalienergia → sähköenergia
voltaic cell on toinen kahdesta sähkökemiallisen solun perustyypistä.Toinen tyyppi on elektrolyyttikenno; elektrolyyttisessä kennossa sähköenergiaa käytetään ei-spontaanin kemiallisen reaktion ajamiseen.Esimerkiksi vesi voidaan elektrolyyttisessä kennossa jakaa vedyksi ja hapeksi. Myös kun ladattava akku ladataan, se toimii elektrolyyttikennona.
Perusjännitteinen Solukaavio

spontaanit redox-reaktiot elektrodeissa tuottavat jännitteen.Oikein asetettuna tämä jännite voi ajaa elektroneja sähkölaitteiden, kuten hehkulampun, läpi here.In tässä kaaviossa lajit siirtävät elektroneja anodille, josta ne virtaavat hehkulampun läpi katodille, jossa ne saavat aikaan pelkistymisen.
elektrolyyttisen Kennon Peruskaavio
ei-spontaani redox-reaktioita ohjaa Ulkoinen jännite.Elektrolyyttikennon prosessit ovat volttikennon prosessien vastakohtia: voimanlähteestä tuleva virta työntää elektroneja katodille, jossa ne aiheuttavat lajien pelkistymistä.
lue täältä lisää katodeista ja anodeista volttisissa vs elektrolyyttisissä kennoissa.
esimerkki Jännitteisestä kennosta
Edisonin akku
Edisonin akku on yksinkertainen, ladattava kenno, jonka keksi Thomas Edison.It koostuu kahdesta metallielektrodista, joista toinen on valmistettu raudasta, toinen nikkelistä.Alkulatauksen aikana nikkelielektrodiin muodostuu nikkelioksidipinnoite.
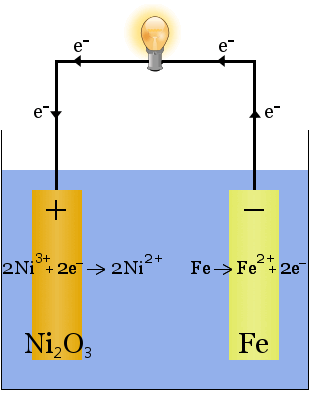
elektrolyytti (elektrodien välissä oleva ionineste) on 20-30 painoprosenttia kaliumhydroksidia vedessä.Kaliumhydroksidin tehtävä tässä tapauksessa on lisätä ioninjohtavuutta sähkövirtapiirin täydentämiseksi-kaliumhydroksidia ei kuluteta reaktiossa.
purkautuessaan Edisonin solu toimii volttisoluna.Kun sitä Ladataan, kenno toimii elektrolyyttisenä kennona.
elektrodeissa tapahtuvien reaktioiden kemialliset yhtälöt ovat:
purkauksen aikana solun antaessa sähköenergiaa yllä olevat reaktiot etenevät oikealle →.
latauksen aikana, kun kenno muuntaa sähköenergiaa kemialliseksi potentiaalienergiaksi, edellä mainitut reaktiot etenevät vasemmalle←.
Edisonin solu, jonka molemmat elektrodit jakavat saman elektrolyytin, on yksi yksinkertaisimmista käytännön käytössä olevista volttisoluista; useimmat jännitteiset solut ovat monimutkaisempia.Sen suuria etuja ovat sen huomattava kestävyys virheitä, kuten ylilatausta vastaan ja sen erittäin pitkä käyttöikä, lähes rajaton latauspurkauspyörästö.
sen suurin haitta on se, että se on energiantuotantoonsa nähden hyvin raskas.
Lisäesimerkki
Litiumparistot
akkuteknologian kehitys on ajanut elektronisten laitteiden pienennyttämistä.Ilman näitä edistysaskeleita nykyaikaiset laitteet, kuten kännykät ja tabletit, olisivat suurempia ja hankalampia.
näiden edistysaskelten ytimessä on ollut litiumionitekniikka.Alkuaine litium on metalli, jonka tiheys on hyvin pieni: 0,534 g/cm3 litium on puolet vettä tiheämpää; litium kelluu veden päällä.Vertaa tätä Edisonin kennon metalleihin, nikkelin tiheys on 8,908 g/cm3 ja raudan 7,874 g/cm3: nämä ovat yli 10x suurempia kuin litiumin tiheys.
litiumin korkea redox-potentiaali yhdistettynä sen alhaiseen tiheyteen tekee sen ioneista täydellisiä käytettäväksi akkumateriaalina.
tyypillinen litiumioniakku perustuu huokoisiin elektrodeihin, joiden avulla Li-ionit pääsevät liikkumaan huokosiensa sisään ja ulos.Esimerkiksi ladattavassa litiumioniakussa voisi olla grafiittielektrodi ja litiumseostetussa kobolttioksidielektrodissa polyoksyetyleenielektrolyytti, joka sisältää suolaa LiPF6.
tällaisen akun virratessa laitetta grafiittianodin kerrosrakenteen sisällä olevat litiumatomit hapettuvat ioneiksi.
katodilla litiumionit pelkistyvät kobolttioksidirakenteen sisällä.
These reactions are reversed when the cell is being charged.
