Courbes de chauffage
La figure \(\PageIndex{3}\) montre une courbe de chauffage, un graphique de la température par rapport au temps de chauffage, pour un échantillon d’eau de 75 g. L’échantillon est initialement de la glace à 1 atm et -23 ° C; à mesure que la chaleur est ajoutée, la température de la glace augmente linéairement avec le temps. La pente de la ligne dépend à la fois de la masse de la glace et de la chaleur spécifique (Cs) de la glace, qui est le nombre de joules nécessaires pour élever la température de 1 g de glace de 1 ° C. À mesure que la température de la glace augmente, les molécules d’eau du cristal de glace absorbent de plus en plus d’énergie et vibrent plus vigoureusement. Au point de fusion, ils ont suffisamment d’énergie cinétique pour surmonter les forces d’attraction et se déplacer les uns par rapport aux autres. Lorsque plus de chaleur est ajoutée, la température du système n’augmente pas davantage mais reste constante à 0 ° C jusqu’à ce que toute la glace ait fondu. Une fois que toute la glace a été convertie en eau liquide, la température de l’eau recommence à augmenter. Maintenant, cependant, la température augmente plus lentement qu’auparavant car la capacité calorifique spécifique de l’eau est supérieure à celle de la glace. Lorsque la température de l’eau atteint 100 ° C, l’eau commence à bouillir. Ici aussi, la température reste constante à 100°C jusqu’à ce que toute l’eau ait été convertie en vapeur. À ce stade, la température recommence à augmenter, mais à un rythme plus rapide que dans les autres phases car la capacité calorifique de la vapeur est inférieure à celle de la glace ou de l’eau.
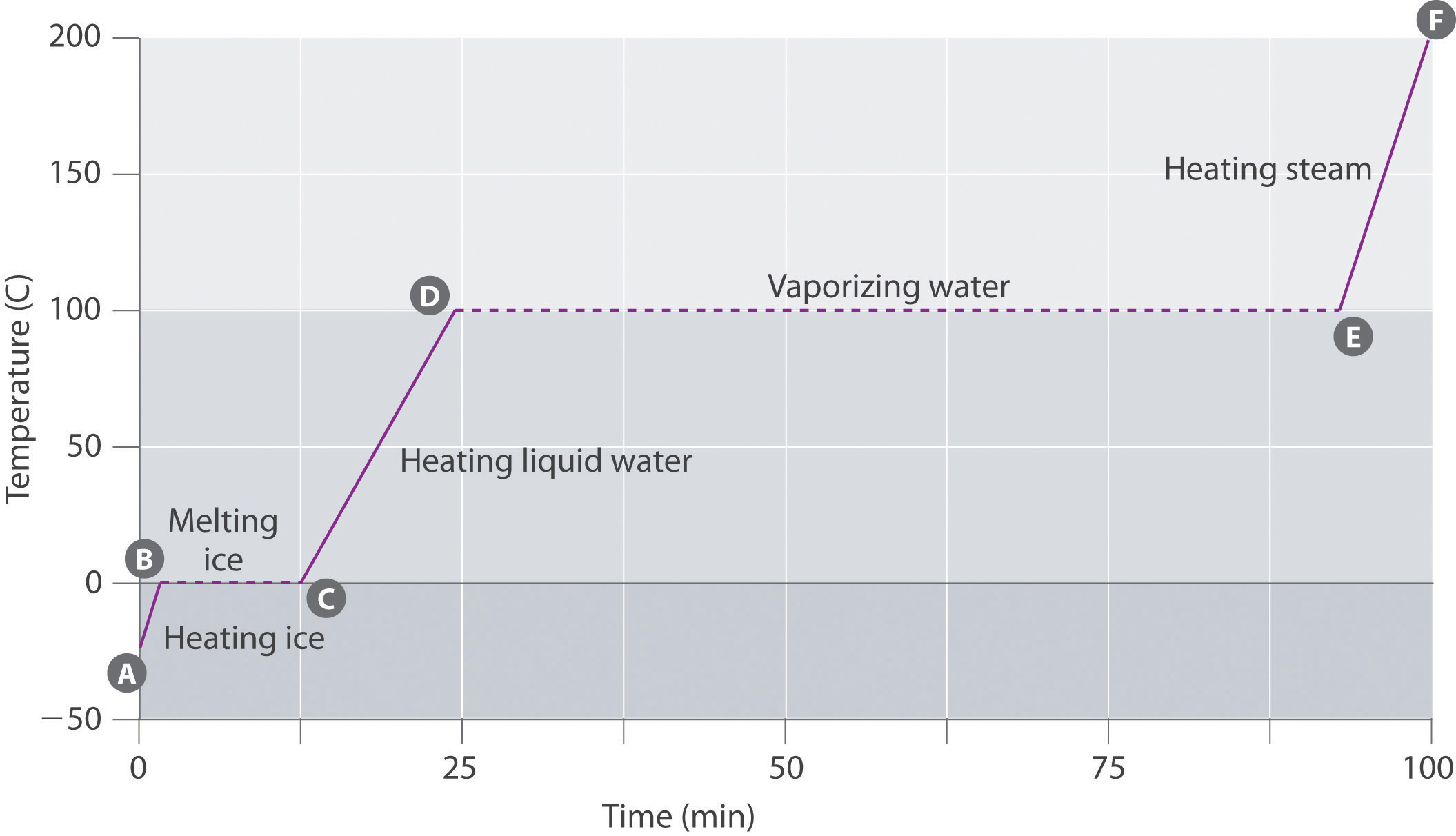
Ainsi, la température d’un système ne change pas lors d’un changement de phase. Dans cet example, tant qu’une quantité même infime de glace est présente, la température du système reste à 0°C pendant le processus de fusion, et tant qu’une quantité même infime d’eau liquide est présente, la température du système reste à 100 °C pendant le processus d’ébullition. La vitesse à laquelle la chaleur est ajoutée n’affecte pas la température du mélange glace / eau ou eau / vapeur, car la chaleur ajoutée est utilisée exclusivement pour vaincre les forces d’attraction qui maintiennent la phase la plus condensée ensemble. Beaucoup de cuisiniers pensent que les aliments cuisent plus rapidement si la chaleur augmente, de sorte que l’eau bout plus rapidement. Au lieu de cela, la casserole d’eau bout à sec plus tôt, mais la température de l’eau ne dépend pas de la vigueur avec laquelle elle bout.
La température d’un échantillon ne change pas lors d’un changement de phase.
Si la chaleur est ajoutée à un taux constant, comme sur la figure \(\PageIndex{3}\), alors la longueur des lignes horizontales, qui représente le temps pendant lequel la température ne change pas, est directement proportionnelle à l’amplitude des enthalpies associées aux changements de phase. Sur la figure \(\PageIndex{3}\), la ligne horizontale à 100°C est beaucoup plus longue que la ligne à 0°C car l’enthalpie de vaporisation de l’eau est plusieurs fois supérieure à l’enthalpie de fusion.
Un liquide surchauffé est un échantillon d’un liquide à la température et à la pression auxquelles il doit être un gaz. Les liquides surchauffés ne sont pas stables; le liquide finira par bouillir, parfois violemment. Le phénomène de surchauffe provoque un « choc” lorsqu’un liquide est chauffé en laboratoire. Lorsqu’un tube à essai contenant de l’eau est chauffé sur un brûleur Bunsen, par exemple, une partie du liquide peut facilement devenir trop chaude. Lorsque le liquide surchauffé se transforme en gaz, il peut pousser ou « cogner” le reste du liquide hors du tube à essai. Placer une tige d’agitation ou un petit morceau de céramique (une « puce bouillante”) dans le tube à essai permet à des bulles de vapeur de se former à la surface de l’objet, de sorte que le liquide bout au lieu de surchauffer. La surchauffe est la raison pour laquelle un liquide chauffé dans une tasse lisse dans un four à micro-ondes peut ne pas bouillir jusqu’à ce que la tasse soit déplacée, lorsque le mouvement de la tasse permet la formation de bulles.