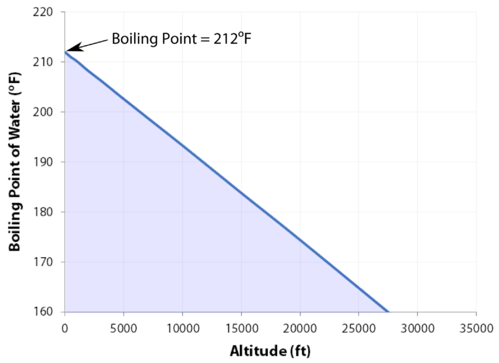
Point d’ébullition
Lorsqu’un liquide est chauffé, l’énergie cinétique moyenne de ses particules augmente. Le taux d’évaporation augmente à mesure que de plus en plus de molécules sont capables de s’échapper de la surface du liquide dans la phase vapeur. Finalement, un point est atteint lorsque les molécules dans tout le liquide ont suffisamment d’énergie cinétique pour se vaporiser. À ce stade, le liquide commence à bouillir. Le point d’ébullition est la température à laquelle la pression de vapeur d’un liquide est égale à la pression externe. La figure ci-dessous illustre l’ébullition du liquide.
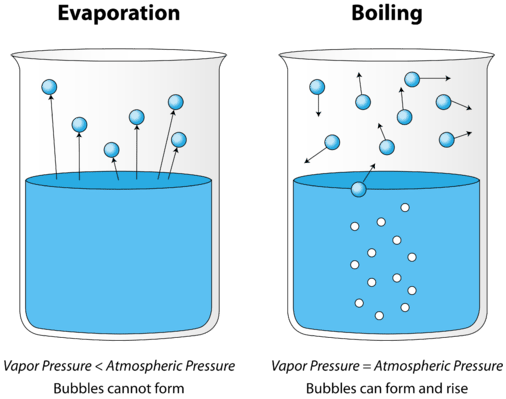
Sur l’image de gauche, le liquide est en dessous de son point d’ébullition, mais une partie du liquide s’évapore. À droite, la température a été augmentée jusqu’à ce que des bulles commencent à se former dans le corps du liquide. Lorsque la pression de vapeur à l’intérieur de la bulle est égale à la pression atmosphérique externe, les bulles remontent à la surface du liquide et éclatent. La température à laquelle ce processus se produit est le point d’ébullition du liquide.
Le point d’ébullition normal est la température à laquelle la pression de vapeur du liquide est égale à la pression standard. Étant donné que la pression atmosphérique peut changer en fonction de l’emplacement, le point d’ébullition d’un liquide change avec la pression externe. Le point d’ébullition normal est une constante car il est défini par rapport à la pression atmosphérique standard de \(760\:\text{mm}\:\ce{Hg}\) (ou \(1\:\text{atm}\) ou \(101,3\:\text{kPa}\)).