Les réactions d’oxydoréduction consistent à transférer des électrons d’une substance à une autre, il est donc utile d’avoir un système pour suivre ce qui gagne et ce qui perd des électrons, et combien d’électrons sont impliqués. Le système d’enregistrement des réactions redox est appelé Nombres d’oxydation. Vous vous souvenez peut-être aussi de quelque chose appelé électronégativité des cours de chimie antérieurs.
Électronégativité
La capacité d’un atome lié à attirer des électrons partagés vers lui-même.
Lorsque deux atomes d’éléments différents sont liés entre eux par une liaison covalente (partageant des électrons), les électrons ne sont généralement pas partagés également entre les deux atomes en raison de différences dans leurs électronégativités. Considérez cela comme un tir à la corde pour les électrons. Parfois, les deux atomes tirent avec une force égale sur des électrons partagés; d’autres fois, il y a clairement un joueur plus fort qui rapprochera les électrons de lui-même.
Considérons la liaison entre un atome d’hydrogène (avec un électron de valence) et un atome d’oxygène (avec ses six électrons de valence):
|
|
+
|
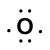 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to l’atome d’hydrogène. Ce n’est pas le transfert total d’électrons qui créerait un ion, mais des charges partielles se forment. L’extrémité hydrogène de la liaison est partiellement positive (+1) car elle a partiellement perdu un électron, et l’extrémité oxygène du H-O est partiellement négative (-1) car elle a partiellement gagné l’électron de l’hydrogène:
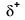 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
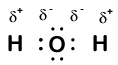
Nous voyons que chacun des deux hydrogènes a « perdu » un électron en oxygène. L’oxygène a « gagné » deux électrons — un de chaque hydrogène. Encore une fois, ce ne sont pas de vrais ions, mais il est utile d’y penser de la même manière.
Les charges ainsi données aux atomes d’une molécule sont appelées nombres d’oxydation. Nous pouvons utiliser les nombres d’oxydation pour garder une trace de l’emplacement des électrons dans une molécule et de la façon dont ils se déplacent pendant une réaction. Dans notre exemple d’eau, l’hydrogène se voit attribuer un numéro d’oxydation de + 1 car chaque hydrogène individuel a « perdu » un électron. L’oxygène a un nombre d’oxydation de + 2 parce que l’atome d’oxygène unique a « gagné » un total de deux électrons, un de chaque hydrogène.
Voici une autre molécule impliquant l’hydrogène et l’oxygène – le peroxyde d’hydrogène, H2O2:
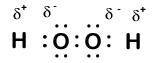
Dans le peroxyde d’hydrogène, chaque hydrogène a toujours un nombre d’oxydation de +1 car chaque hydrogène « cède » un seul électron à l’oxygène. L’oxygène, cependant, a maintenant un nombre d’oxydation de -1 car chaque oxygène ne gagne qu’un électron de son hydrogène voisin. Les électrons entre les deux atomes d’oxygène identiques sont partagés également, il n’y a donc pas de charge partielle résultant de cette liaison.
Nombre d’oxydation
Un nombre positif ou négatif attribué à un atome dans une molécule ou un ion qui reflète un gain ou une perte partielle d’électrons.
Connaître le nombre d’oxydation de chaque élément individuel d’une molécule sera une étape clé dans notre compréhension des réactions redox. Heureusement, cela n’impliquera généralement pas de dessiner des diagrammes à points électroniques. Au lieu de cela, il existe une série de règles que nous pouvons utiliser pour déterminer les nombres d’oxydation. Voici les règles principales:
| Le nombre d’oxydation d’un élément pur (par lui-même, et non un ion) est nul. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal à sa charge. Les métaux alcalins — éléments de la première colonne du tableau périodique — auront toujours un nombre d’oxydation de +1; Les métaux alcalino-terreux (colonne 2) sont presque toujours +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le nombre d’oxydation de l’oxygène est presque toujours de -2 lorsqu’il se trouve dans un composé. Les exceptions :
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La somme des nombres d’oxydation dans un composé est nulle. Pour déterminer le nombre d’oxydation de Mn dans Mn2O7, nous devons travailler en arrière:
-2 × 7 atomes = -14 total Puisque la somme des nombres d’oxydation doit être nulle, le nombre total d’oxydation de Mn doit être de +14 pour annuler le -14 de l’oxygène, mais comme il y a 2 atomes de Mn, chaque atome individuel aura un nombre d’oxydation de +7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La somme des nombres d’oxydation dans un ion polyatomique est égale à la charge sur cet ion. Encore une fois, travaillez en arrière pour déterminer le nombre d’oxydation de tout atome non oxygène ou non hydrogène. Pour déterminer le nombre d’oxydation de Cr dans Cr2O72 -:
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is il est important de noter que le nombre d’oxydation se réfère toujours à chaque atome individuel du composé, et non au total de cet élément.
Par exemple, en H2O, la « charge » positive totale pour les deux atomes d’hydrogène sera de +2 (ce qui s’équilibre avec le -2 de l’oxygène), mais chaque hydrogène a un nombre d’oxydation de +1.
Contributions&Attributions
Cette page a été construite à partir du contenu via le(s) contributeur(s) suivant(s) et éditée (de manière topique ou extensive) par l’équipe de développement de LibreTexts pour répondre au style, à la présentation et à la qualité de la plate-forme:
-
Fondation CK-12 par Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson et Jean Dupon.