Objectifs d’apprentissage
- Utilisez la notation cellulaire pour décrire les cellules galvaniques
- Décrivez les composants de base des cellules galvaniques\
Les cellules galvaniques, également appelées cellules voltaïques, sont des cellules électrochimiques dans lesquelles des réactions d’oxydoréduction spontanées produisent de l’énergie électrique. Lors de la rédaction des équations, il est souvent pratique de séparer les réactions d’oxydoréduction en demi-réactions pour faciliter l’équilibrage de l’équation globale et mettre l’accent sur les transformations chimiques réelles.
Considérez ce qui se passe lorsqu’un morceau de cuivre métallique propre est placé dans une solution de nitrate d’argent (Figure\(\PageIndex{1}\)). Dès que le métal de cuivre est ajouté, le métal argenté commence à se former et les ions de cuivre passent dans la solution. La couleur bleue de la solution à l’extrême droite indique la présence d’ions cuivre. La réaction peut être divisée en deux demi-réactions. Les demi-réactions séparent l’oxydation de la réduction, de sorte que chacune peut être considérée individuellement.
L’équation de la demi-réaction de réduction devait être doublée de sorte que le nombre d’électrons « gagnés” dans la demi-réaction de réduction égalait le nombre d’électrons « perdus” dans la demi-réaction d’oxydation.

Les cellules galvaniques ou voltaïques impliquent des réactions électrochimiques spontanées dans lesquelles les demi-réactions sont séparées (Figure\(\PageIndex{2}\)) afin que le courant puisse circuler à travers un fil externe. Le bécher sur le côté gauche de la figure est appelé demi-cellule et contient une solution de 1 M de nitrate de cuivre (II) avec un morceau de cuivre métallique partiellement immergé dans la solution. Le métal de cuivre est une électrode. Le cuivre subit une oxydation; par conséquent, l’électrode de cuivre est l’anode. L’anode est connectée à un voltmètre avec un fil et l’autre borne du voltmètre est connectée à une électrode d’argent par un fil. L’argent subit une réduction; par conséquent, l’électrode d’argent est la cathode. La demi-cellule sur le côté droit de la figure est constituée de l’électrode d’argent dans une solution de nitrate d’argent à 1 M (AgNO3). À ce stade, aucun courant ne circule, c’est—à-dire qu’aucun mouvement significatif d’électrons à travers le fil ne se produit car le circuit est ouvert. Le circuit est fermé à l’aide d’un pont de sel, qui transmet le courant avec des ions en mouvement. Le pont de sel est constitué d’une solution électrolytique concentrée, non réactive, telle que la solution de nitrate de sodium (NaNO3) utilisée dans cet example. Lorsque les électrons s’écoulent de gauche à droite à travers l’électrode et le fil, les ions nitrate (anions) traversent le bouchon poreux à gauche dans la solution de nitrate de cuivre (II). Cela maintient le bécher à gauche électriquement neutre en neutralisant la charge sur les ions cuivre (II) qui sont produits dans la solution lorsque le cuivre métallique est oxydé. En même temps, les ions nitrate se déplacent vers la gauche, les ions sodium (cations) se déplacent vers la droite, à travers le bouchon poreux et dans la solution de nitrate d’argent à droite. Ces cations ajoutés « remplacent » les ions d’argent qui sont retirés de la solution car ils ont été réduits en métal argenté, maintenant le bécher à droite électriquement neutre. Sans le pont de sel, les compartiments ne resteraient pas électriquement neutres et aucun courant significatif ne circulerait. Cependant, si les deux compartiments sont en contact direct, un pont de sel n’est pas nécessaire. L’instant où le circuit est terminé, le voltmètre lit + 0,46 V, c’est ce qu’on appelle le potentiel de la cellule. Le potentiel cellulaire est créé lorsque les deux métaux différents sont connectés, et est une mesure de l’énergie par charge unitaire disponible à partir de la réaction d’oxydoréduction. Le volt est l’unité SI dérivée du potentiel électrique
\
Dans cette équation, A est le courant en ampères et C la charge en coulombs. Notez que les volts doivent être multipliés par la charge en coulombs (C) pour obtenir l’énergie en joules (J).
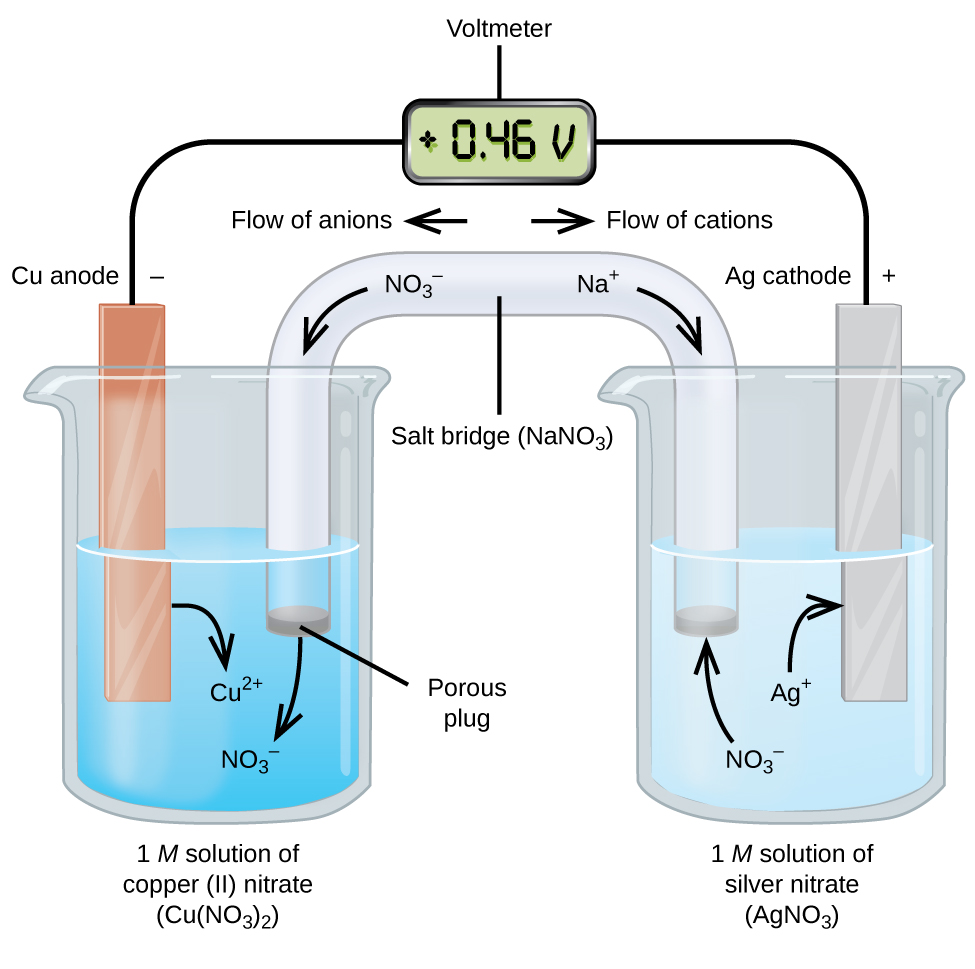
Lorsque la cellule électrochimique est construite de cette manière, un potentiel de cellule positif indique une réaction spontanée et que les électrons circulent de gauche à droite. Il se passe beaucoup de choses dans Figure \(\PageIndex{2}\), il est donc utile de résumer les choses pour ce système:
- Les électrons circulent de l’anode à la cathode: de gauche à droite dans la cellule galvanique standard de la figure.
- L’électrode dans la demi-cellule gauche est l’anode car l’oxydation se produit ici. Le nom fait référence au flux d’anions dans le pont de sel vers lui.
- L’électrode dans la demi-cellule droite est la cathode car la réduction se produit ici. Le nom fait référence au flux de cations dans le pont de sel vers celui-ci.
- L’oxydation se produit à l’anode (la demi-cellule gauche sur la figure).
- La réduction se produit au niveau de la cathode (la demi-cellule droite sur la figure).
- Le potentiel cellulaire, +0,46 V, résulte ici des différences inhérentes à la nature des matériaux utilisés pour réaliser les deux demi-cellules.
- Le pont de sel doit être présent pour fermer (compléter) le circuit et une oxydation et une réduction doivent se produire pour que le courant circule.
Il y a beaucoup de cellules galvaniques possibles, donc une notation sténographique est généralement utilisée pour les décrire. La notation cellulaire (parfois appelée diagramme cellulaire) fournit des informations sur les différentes espèces impliquées dans la réaction. Cette notation fonctionne également pour d’autres types de cellules. Une ligne verticale, │, désigne une limite de phase et une double ligne, │, le pont de sel. Les informations sur l’anode sont écrites à gauche, suivies de la solution d’anode, puis du pont de sel (lorsqu’il est présent), puis de la solution de cathode et, enfin, des informations sur la cathode à droite. La notation cellulaire de la cellule galvanique de la figure \(\PageIndex{2}\) est alors
\
Notez que les ions spectateurs ne sont pas inclus et que la forme la plus simple de chaque demi-réaction a été utilisée. Lorsqu’elles sont connues, les concentrations initiales des différents ions sont généralement incluses.
L’une des cellules les plus simples est la cellule de Daniell. Il est possible de construire cette batterie en plaçant une électrode en cuivre au fond d’un bocal et en recouvrant le métal d’une solution de sulfate de cuivre. Une solution de sulfate de zinc est flottée sur la solution de sulfate de cuivre; puis une électrode de zinc est placée dans la solution de sulfate de zinc. La connexion de l’électrode de cuivre à l’électrode de zinc permet à un courant électrique de circuler. Ceci est un exemple de cellule sans pont de sel, et les ions peuvent circuler à travers l’interface entre les deux solutions.
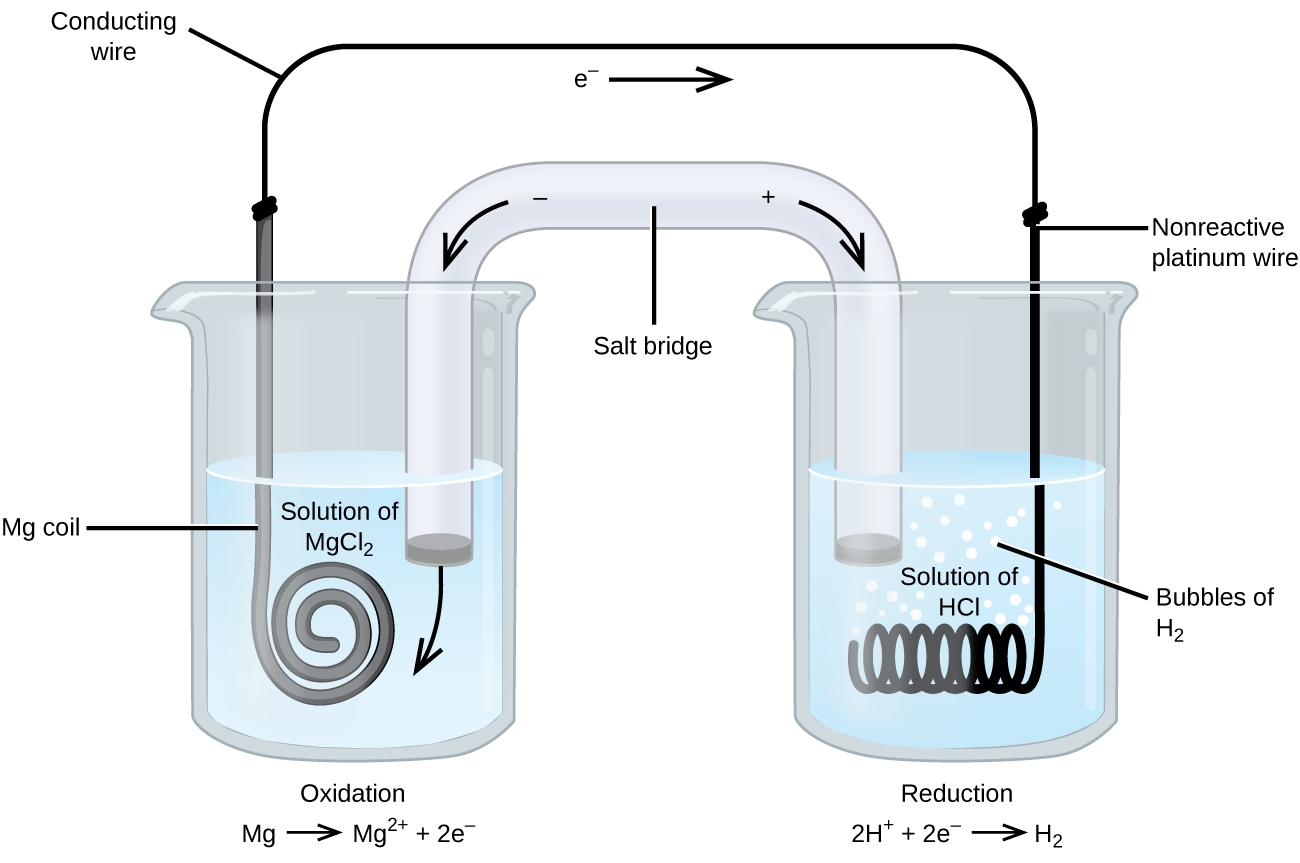
Certaines réactions d’oxydoréduction impliquent des espèces qui sont de mauvais conducteurs d’électricité, et on utilise donc une électrode qui ne participe pas aux réactions. Souvent, l’électrode est en platine, en or ou en graphite, qui sont tous inertes à de nombreuses réactions chimiques. Un tel système est illustré dans la figure \(\PageIndex{3}\). Le magnésium subit une oxydation à l’anode de gauche sur la figure et les ions hydrogène subissent une réduction à la cathode de droite. La réaction peut être résumée par
La cellule a utilisé un fil de platine inerte pour la cathode, donc la notation de la cellule est
L’électrode de magnésium est une électrode active car elle participe à la réaction d’oxydoréduction. Les électrodes inertes, comme l’électrode de platine de la figure \(\PageIndex{3}\), ne participent pas à la réaction d’oxydoréduction et sont présentes pour que le courant puisse circuler dans la cellule. Le platine ou l’or font généralement de bonnes électrodes inertes car elles ne réagissent pas chimiquement.
Exemple \(\PageIndex{1}\): En utilisant la notation cellulaire
Considérons une cellule galvanique constituée de
\
Écrivez les demi-réactions d’oxydation et de réduction et écrivez la réaction en utilisant la notation cellulaire. Quelle réaction se produit à l’anode? La cathode ?
Solution
Par inspection, Cr est oxydé lorsque trois électrons sont perdus pour former Cr3+, et Cu2+ est réduit lorsqu’il gagne deux électrons pour former Cu. L’équilibrage de la charge donne
\
La notation cellulaire utilise la forme la plus simple de chacune des équations et commence par la réaction à l’anode. Aucune concentration n’a été spécifiée ainsi:
\
L’oxydation se produit à l’anode et la réduction à la cathode.
Exemple \(\PageIndex{2}\): En utilisant la notation cellulaire
Considérons une cellule galvanique constituée de
Écrivez les demi-réactions d’oxydation et de réduction et écrivez la réaction en utilisant la notation cellulaire. Quelle réaction se produit à l’anode? La cathode ?
Solution
Par inspection, Fe2+ subit une oxydation lorsqu’un électron est perdu pour former Fe3+, et MnO4- est réduit lorsqu’il gagne cinq électrons pour former Mn2+. L’équilibrage de la charge donne
\
La notation cellulaire utilise la forme la plus simple de chacune des équations et commence par la réaction à l’anode. Il est nécessaire d’utiliser une électrode inerte, telle que le platine, car il n’y a pas de métal présent pour conduire les électrons de l’anode à la cathode. Aucune concentration n’a été spécifiée ainsi:
\
L’oxydation se produit à l’anode et la réduction à la cathode.
Exercice \(\PageIndex{1}\)
Utilisez la notation cellulaire pour décrire la cellule galvanique où les ions cuivre (II) sont réduits en cuivre métallique et le zinc métallique est oxydé en ions zinc.
Réponse
À partir des informations données dans le problème:
\
En utilisant la notation des cellules:
\
Résumé
Les cellules électrochimiques sont généralement constituées de deux demi-cellules. Les demi-cellules séparent la demi-réaction d’oxydation de la demi-réaction de réduction et permettent au courant de circuler à travers un fil externe. Une demi-cellule, normalement représentée sur le côté gauche sur une figure, contient l’anode. L’oxydation se produit à l’anode. L’anode est reliée à la cathode dans l’autre demi-cellule, souvent représentée sur le côté droit sur une figure. La réduction se produit à la cathode. L’ajout d’un pont de sel complète le circuit permettant au courant de circuler. Les anions du pont de sel s’écoulent vers l’anode et les cations du pont de sel s’écoulent vers la cathode. Le mouvement de ces ions complète le circuit et maintient chaque demi-cellule électriquement neutre. Les cellules électrochimiques peuvent être décrites en utilisant la notation des cellules. Dans cette notation, des informations sur la réaction à l’anode apparaissent à gauche et des informations sur la réaction à la cathode à droite. Le pont de sel est représenté par une double ligne, ‖. Les phases solides, liquides ou aqueuses au sein d’une demi-cellule sont séparées par une seule ligne, │. La phase et la concentration des différentes espèces sont indiquées après le nom de l’espèce. Les électrodes qui participent à la réaction d’oxydoréduction sont appelées électrodes actives. Les électrodes qui ne participent pas à la réaction d’oxydoréduction mais qui sont là pour permettre la circulation du courant sont des électrodes inertes. Les électrodes inertes sont souvent fabriquées à partir de platine ou d’or, qui sont inchangées par de nombreuses réactions chimiques.
Glossaire
électrode active électrode qui participe à la réaction d’oxydoréduction d’une cellule électrochimique; la masse d’une électrode active change au cours de la réaction d’oxydoréduction électrode d’anode dans une cellule électrochimique au niveau de laquelle l’oxydation se produit; des informations sur l’anode sont enregistrées sur le côté gauche du pont de sel en notation de cellule électrode de cathode dans une cellule électrochimique au niveau de laquelle une réduction se produit; des informations sur la cathode sont enregistrées sur le côté droit du pont de sel en notation de cellule manière abrégée de notation de cellule pour représenter les réactions dans une cellule électrochimique différence de potentiel; la force motrice pour le flux de charge (courant) dans les réactions d’oxydoréduction cellule galvanique cellule électrochimique qui implique une réaction d’oxydoréduction spontanée; cellules électrochimiques avec des potentiels de cellules positifs; également appelée électrode inerte à cellule voltaïque électrode qui permet au courant de circuler, mais qui ne participe pas autrement à la réaction d’oxydoréduction dans une cellule électrochimique; la masse d’une électrode inerte ne change pas pendant la réaction d’oxydoréduction; les électrodes inertes sont souvent en platine ou en or car ces métaux ne réagissent pas chimiquement. cellule voltaïque un autre nom pour une cellule galvanique
Contributeurs et attributions
-
Paul Flowers (Université de Caroline du Nord – Pembroke), Klaus Theopold (Université du Delaware) et Richard Langley (Stephen F. Austin State University) avec des auteurs contributeurs. Le contenu des manuels produit par OpenStax College est sous licence Creative Commons Attribution License 4.0. Téléchargez gratuitement à http://cnx.org/contents/85abf193-2bd…[email protected]).