Suivant: 3.4 Réfrigérateurs et Chauffe: 3. La Première Loi Précédente: 3.2 Représentation généralisée de l’Indice de Contenu
Un cycle de Carnot est représenté sur la Figure 3.4. Il aquatre processus. Il y a deux jambes réversibles adiabatiques et deux jambes réversibles isothermes. Nous pouvons construire un cycle de Carnot avec de nombreux systèmes différents, mais les concepts peuvent être montrés en utilisant un fluide de travail familier, le gaz idéal. Le système peut être considéré commeune chambre fermée par un piston et remplie de ce gaz idéal.
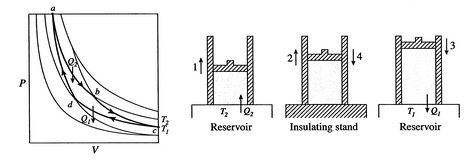
Les quatre processus du cycle de Carnot sont:
- Le système est à la température
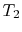 à l’état
à l’état  . Il est mis en contact avec un réservoir de chaleur, qui n’est qu’une masse liquide ou solide suffisamment étendue pour que sa température ne change pas sensiblement lorsqu’une certaine quantité de chaleur est transférée au système. En d’autres termes, le réservoir de chaleur est une température constantesource (ou récepteur) de chaleur. Le système subit ensuite anisothermal expansion de
. Il est mis en contact avec un réservoir de chaleur, qui n’est qu’une masse liquide ou solide suffisamment étendue pour que sa température ne change pas sensiblement lorsqu’une certaine quantité de chaleur est transférée au système. En d’autres termes, le réservoir de chaleur est une température constantesource (ou récepteur) de chaleur. Le système subit ensuite anisothermal expansion de  de
de 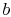 , avec la chaleur absorbée à l’
, avec la chaleur absorbée à l’ 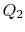 .
. - Atstate
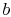 , le système est isolé thermiquement (retiré du contact avec le réservoir de chaleur), puis laissez s’étendre jusqu’à
, le système est isolé thermiquement (retiré du contact avec le réservoir de chaleur), puis laissez s’étendre jusqu’à 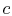 . Pendant cette expansion, la température diminue jusqu’à
. Pendant cette expansion, la température diminue jusqu’à 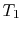 . L’échange de chaleur pendant cette partie du cycle,
. L’échange de chaleur pendant cette partie du cycle, 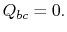 )
) - À l’état
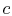 le système est mis en contact avec un réservoir de chaleur à température
le système est mis en contact avec un réservoir de chaleur à température 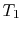 . Il est ensuite compressé à l’état
. Il est ensuite compressé à l’état 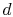 , rejetant la chaleur
, rejetant la chaleur 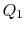 dans le processus.
dans le processus. - Enfin, le système est compressé adiabatiquement à l’état initial
 . L’échange de chaleur
. L’échange de chaleur 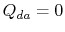 .
.
L’efficacité thermique du cycle est donnée par la définition
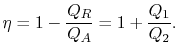 |
(3..4) |
Dans cette équation, il y a une convention de signe implicite. Les quantités ![]() ,
, ![]() telles que définies sont les grandeurs de la chaleur absorbée et injectée. Les quantités
telles que définies sont les grandeurs de la chaleur absorbée et injectée. Les quantités ![]() ,
, ![]() en revanche sont définies en référence à la chaleur reçue par le système. Dans cet exemple, l’ancien est négatif et ce dernier est positif. La chaleur absorbée et injectée par le système a lieu lors de processus isothermes et nous savons déjà quelles sont leurs valeurs d’Eq.(3.1):
en revanche sont définies en référence à la chaleur reçue par le système. Dans cet exemple, l’ancien est négatif et ce dernier est positif. La chaleur absorbée et injectée par le système a lieu lors de processus isothermes et nous savons déjà quelles sont leurs valeurs d’Eq.(3.1):
L’efficacité peut maintenant être écrite en termes de volumes aux différents états comme
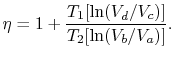 |
(3..5) |
The path from states ![]() to
to ![]() and from
and from ![]() to
to ![]() are bothadiabatic and reversible. For a reversible adiabatic process we knowthat
are bothadiabatic and reversible. For a reversible adiabatic process we knowthat ![]() . Using the ideal gas equation ofstate, we have
. Using the ideal gas equation ofstate, we have ![]() . Along curve
. Along curve![]()
![]() , therefore,
, therefore, ![]() . Alongthe curve
. Alongthe curve ![]()
![]()
![]() . Thus,
. Thus,

Comparing the expression for thermal efficiencyEq. (3.4) with Eq. (3.5) montre deux conséquences. Tout d’abord, les chaleurs reçues et rejetées sont liées aux températures des parties isothermes du cycle par
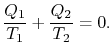 |
(3..6) |
Deuxièmement, l’efficacité d’un cycle de Carnot est donnée de manière compacte par
 |
(3..7) |
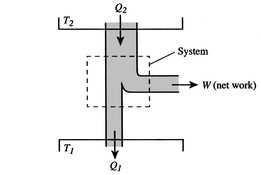
L’efficacité ne peut être de 100% que si la température à laquelle la chaleur est rejetée est nulle. Les transferts de chaleur et de travail vers et depuis le système sont schématisés en figure 3.5.
Boueux Points
Depuis ![]() , en regardant le
, en regardant le ![]()
![]() graphique, doesthat dire les plus éloignés de la
graphique, doesthat dire les plus éloignés de la ![]()
![]() isothermes sont, thegreater efficacité? Et que s’ils étaient très proches, ce seraittrès inefficace? (MP 3.2)
isothermes sont, thegreater efficacité? Et que s’ils étaient très proches, ce seraittrès inefficace? (MP 3.2)
Dans le cycle de Carnot, pourquoi ne traitons-nous que des changements de volume et pas des changements de pression sur les adiabates et les isothermes?(MP 3.3)
Existe-t-il une application physique pour le cycle de Carnot ? Peut-on concevoir un moteur Carnot pour un dispositif de propulsion ?(MP 3.4)
Comment savons-nous quels cycles utiliser comme modèles pour des processus réels?(MP 3.5)
Suivant: 3.4Réfrigérateurs et Chauffer: 3. La Première Loi Précédente: 3.2 Représentation généralisée de l’Index des contenus
UnifiedTP