La théorie de l’hybridation est souvent considérée comme un concept long et déroutant et c’est une compétence pratique de pouvoir déterminer rapidement si l’atome est sp3, sp2 ou sp sans avoir à parcourir tous les détails de la façon dont l’hybridation s’est produite.
Heureusement, il y a un raccourci à faire cela et dans ce post, je vais essayer de résumer cela en quelques étapes distinctes que vous devez suivre.
Disons qu’on vous demande de déterminer l’état d’hybridation des atomes numérotés dans la molécule suivante:

La première chose à faire est de déterminer le nombre de groupes qui se trouvent sur chaque atome. Par groupes, nous entendons soit des atomes, soit des paires isolées d’électrons. Ceci est également connu sous le nom de nombre stérique (SN).

Voici quelques exemples de nombres stériques 2-4 qui sont en grande partie ce que vous devez savoir en chimie organique:

Notez que les liaisons multiples n’ont pas d’importance, ce sont des atomes + paires solitaires pour n’importe quel type de liaison.
Une fois que vous savez comment déterminer le nombre stérique (il provient de la théorie VSEPR), il vous suffit d’appliquer la corrélation suivante:
Si le nombre stérique est 4, il s’agit de sp3
Si le nombre stérique est 3–sp2
Si le nombre stérique est 2–sp
Alors maintenant, revenons à notre molécule et déterminons les états d’hybridation pour tous les atomes.
C1–SN =3 (trois atomes connectés), donc c’est sp2
C2–SN =3 (trois atomes connectés), donc c’est sp2
O4–SN =3 (1 atome + 2 paires solitaires), donc c’est sp2
O5–SN = 4 (2 atomes + 2 paires solitaires), donc c’est sp3
C6–SN = 4 (4 atomes), donc c’est sp3
C7–SN = 4 (4 atomes), donc c’est sp3
N8–SN = 4 (3 atomes + 1 paire isolée), donc c’est sp3
C9–SN = 2 (2 atomes), donc c’est sp
C10–SN = 2 (2 atomes), donc c’est sp

En plus de cette méthode, il est également très utile de se souvenir de certains traits liés à la structure et à l’hybridation. En général, un atome avec toutes les liaisons simples est un sp3 hybridé. Le meilleur exemple est les alcanes. Tous les atomes de carbone d’un alcane sont hybridés sp3 avec une géométrie tétraédrique.
Les carbones des alcènes et d’autres atomes à double liaison sont souvent hybridés sp2 et ont une géométrie plane trigonale.
La triple liaison, en revanche, est caractéristique des alcynes où les atomes de carbone sont hybridés sp.
Il y a quelques exceptions courantes à ce que nous avons discuté de la détermination de l’état d’hybridation et elles sont principalement liées à la méthode où nous examinons le type de liaison de l’atome.
Par exemple, dans le dioxyde de carbone (CO2), le carbone a deux doubles liaisons, mais il est hybridé sp.
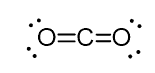
Et la raison en est le fait que le nombre stérique du carbone est de deux (il n’y a que deux atomes d’oxygène qui lui sont connectés) et pour garder deux atomes à 180o, qui est la géométrie optimale, le carbone doit utiliser deux orbitales identiques. Ceci n’est possible que dans l’hybridation sp. Les deux autres orbitales 2p sont utilisées pour réaliser les doubles liaisons de chaque côté du carbone.
Un autre exemple commun et très important est les carbocations.

Ici, le carbone n’a que des liaisons simples et il peut sembler qu’il est supposé être hybridé sp3. Cependant, le carbone dans ce type de carbocations est hybridé sp2. Encore une fois, pour la même raison, que son nombre stérique est 3 (sp2 – trois orbitales identiques).
Une exception à la méthode des nombres stériques
Une exception avec le nombre stérique est, par exemple, les amides. L’atome d’azote a ici un numéro stérique 4 et devrait être sp3. Cependant, en raison de la délocalisation de résonance de la paire isolée, elle interconverse de sp3 à sp2 car c’est la seule façon d’avoir les électrons dans une orbitale p alignée qui peut se chevaucher et participer à la stabilisation de résonance avec les électrons de liaison pi de la double liaison C = O.

Dans la plupart des cas, vous n’aurez pas à vous soucier des exceptions si vous y allez en fonction du nombre stérique.