Mécanismes de la catalyse enzymatique
La liaison d’un substrat au site actif d’une enzyme est une interaction très spécifique. Les sites actifs sont des fentes ou des rainures à la surface d’une enzyme, généralement composées d’acides aminés provenant de différentes parties de la chaîne polypeptidique qui sont réunis dans la structure tertiaire de la protéine pliée. Les substrats se lient initialement au site actif par des interactions non covalentes, y compris des liaisons hydrogène, des liaisons ioniques et des interactions hydrophobes. Une fois qu’un substrat est lié au site actif d’une enzyme, de multiples mécanismes peuvent accélérer sa conversion en produit de la réaction.
Bien que l’exemple simple discuté dans la section précédente ne concerne qu’une seule molécule de substrat, la plupart des réactions biochimiques impliquent des interactions entre deux substrats différents ou plus. Par exemple, la formation d’une liaison peptidique implique la jonction de deux acides aminés. Pour de telles réactions, la liaison de deux substrats ou plus au site actif dans la position et l’orientation appropriées accélère la réaction (Figure 2.23). L’enzyme fournit un modèle sur lequel les réactifs sont réunis et correctement orientés pour favoriser la formation de l’état de transition dans lequel ils interagissent.

Figure 2.23
Catalyse enzymatique d’une réaction entre deux substrats. L’enzyme fournit un gabarit sur lequel les deux substrats sont réunis dans la position et l’orientation appropriées pour réagir l’un avec l’autre.
Les enzymes accélèrent également les réactions en modifiant la conformation de leurs substrats pour s’approcher de celle de l’état de transition. Le modèle le plus simple d’interaction enzyme-substrat est le modèle à clé, dans lequel le substrat s’insère précisément dans le site actif (figure 2.24). Dans de nombreux cas, cependant, les configurations de l’enzyme et du substrat sont modifiées par la liaison du substrat — un processus appelé ajustement induit. Dans de tels cas, la conformation du substrat est modifiée de sorte qu’elle ressemble plus à celle de l’état de transition. La contrainte produite par une telle distorsion du substrat peut en outre faciliter sa conversion à l’état de transition en affaiblissant les liaisons critiques. De plus, l’état de transition est stabilisé par sa liaison étroite à l’enzyme, réduisant ainsi l’énergie d’activation requise.

Figure 2.24
Modèles d’interaction enzyme-substrat. (A) Dans le modèle à clé, le substrat s’insère précisément dans le site actif de l’enzyme. (B) Dans le modèle d’ajustement induit, la liaison au substrat déforme les conformations du substrat et de l’enzyme. Cette distorsion (plus…)
En plus de réunir plusieurs substrats et de déformer la conformation des substrats pour approcher l’état de transition, de nombreuses enzymes participent directement au processus catalytique. Dans de tels cas, des chaînes latérales d’acides aminés spécifiques dans le site actif peuvent réagir avec le substrat et former des liaisons avec des intermédiaires de réaction. Les acides aminés acides et basiques sont souvent impliqués dans ces mécanismes catalytiques, comme illustré dans la discussion suivante de la chymotrypsine comme exemple de catalyse enzymatique.
La chymotrypsine est un membre d’une famille d’enzymes (sérine protéases) qui digèrent les protéines en catalysant l’hydrolyse des liaisons peptidiques. La réaction peut s’écrire comme suit :

Les différents membres de la famille des sérines protéases (y compris la chymotrypsine, la trypsine, l’élastase et la thrombine) ont des spécificités de substrat distinctes; ils clivent préférentiellement les liaisons peptidiques adjacentes à différents acides aminés. Par exemple, alors que la chymotrypsine digère les liaisons adjacentes aux acides aminés hydrophobes, tels que le tryptophane et la phénylalanine, la trypsine digère les liaisons à côté des acides aminés basiques, tels que la lysine et l’arginine. Cependant, toutes les protéases à sérine ont une structure similaire et utilisent le même mécanisme de catalyse. Les sites actifs de ces enzymes contiennent trois acides aminés critiques – la sérine, l’histidine et l’aspartate — qui stimulent l’hydrolyse de la liaison peptidique. En effet, ces enzymes sont appelées protéases sérines en raison du rôle central du résidu sérine.
Les substrats se lient aux sérines protéases par insertion de l’acide aminé adjacent au site de clivage dans une poche au site actif de l’enzyme (Figure 2.25). La nature de cette poche détermine la spécificité du substrat des différents membres de la famille des sérines protéases. Par exemple, la poche de liaison de la chymotrypsine contient des acides aminés hydrophobes qui interagissent avec les chaînes latérales hydrophobes de ses substrats préférés. En revanche, la poche de liaison de la trypsine contient un acide aminé acide chargé négativement (aspartate), capable de former une liaison ionique avec les résidus de lysine ou d’arginine de ses substrats.
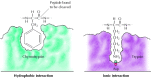
Figure 2.25
Liaison du substrat par des protéases à sérines. L’acide aminé adjacent à la liaison peptidique à cliver est inséré dans une poche au niveau du site actif de l’enzyme. Dans la chymotrypsine, la poche lie les acides aminés hydrophobes; la poche de liaison de la trypsine contient (plus…)
La liaison au substrat positionne la liaison peptidique à cliver adjacente au site actif sérine (Figure 2.26). Le proton de cette sérine est ensuite transféré sur le site actif de l’histidine. La conformation du site actif favorise ce transfert de protons car l’histidine interagit avec le résidu aspartate chargé négativement. La sérine réagit avec le substrat, formant un état de transition tétraédrique. La liaison peptidique est ensuite clivée et la partie C-terminale du substrat est libérée de l’enzyme. Cependant, le peptide N-terminal reste lié à la sérine. Cette situation est résolue lorsqu’une molécule d’eau (le deuxième substrat) pénètre dans le site actif et inverse les réactions précédentes. Le proton de la molécule d’eau est transféré à l’histidine et son groupe hydroxyle est transféré au peptide, formant un deuxième état de transition tétraédrique. Le proton est ensuite transféré de l’histidine à la sérine et le peptide est libéré de l’enzyme, complétant la réaction.

Figure 2.26
Mécanisme catalytique de la chymotrypsine. Trois acides aminés au site actif (Ser-195, His-57 et Asp-102) jouent un rôle essentiel dans la catalyse.
Cet exemple illustre plusieurs caractéristiques de la catalyse enzymatique ; la spécificité des interactions enzyme-substrat, le positionnement de différentes molécules de substrat dans le site actif, et l’implication des résidus de site actif dans la formation et la stabilisation de l’état de transition. Bien que les milliers d’enzymes dans les cellules catalysent de nombreux types de réactions chimiques, les mêmes principes de base s’appliquent à leur fonctionnement.