Une cellule voltaïque, souvent appelée cellule galvanique, fournit de l’énergie électrique. La source de cette énergie est une réaction chimique spontanée, plus précisément une réaction rédox spontanée.
Par exemple, toutes les batteries sont constituées d’une ou plusieurs cellules voltaïques; les batteries sont à plat lorsque la plupart ou la totalité de leurs réactifs ont été convertis en produits, transformant leur énergie potentielle chimique en énergie électrique.
Cellules voltaïques – Le Processus de base
Énergie potentielle chimique → Énergie électrique
La cellule voltaïque est l’un des deux types de base de cellule électrochimique.L’autre type est la cellule électrolytique; dans une cellule électrolytique, l’énergie électrique est utilisée pour conduire une réaction chimique non spontanée.Par exemple, l’eau peut être divisée en hydrogène et en oxygène dans une cellule électrolytique. De plus, lorsqu’une batterie rechargeable est rechargée, elle fonctionne comme une cellule électrolytique.
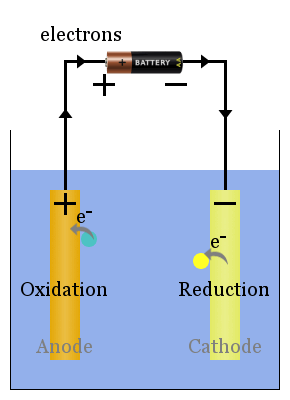
Schéma de base de la cellule voltaïque

Les réactions redox spontanées au niveau des électrodes produisent une tension.Correctement configurée, cette tension peut entraîner des électrons à travers des appareils électriques, tels que l’ampoule illustrée here.In sur ce diagramme, les espèces transfèrent les électrons à l’anode d’où ils traversent l’ampoule à la cathode, où ils provoquent une réduction.
Schéma de base de la cellule électrolytique
Non spontanée les réactions redox sont entraînées par une tension externe.Les processus de la cellule électrolytique sont à l’opposé de ceux de la cellule voltaïque.Le courant de la source d’énergie pousse les électrons vers la cathode, où ils provoquent une réduction des espèces.
En savoir plus ici sur les cathodes et les anodes dans les cellules voltaïques vs électrolytiques.
Exemple de cellule Voltaïque
La batterie Edison
La batterie Edison est une cellule simple et rechargeable inventée par Thomas Edison.It se compose de deux électrodes métalliques, l’une en fer, l’autre en nickel.Lors de la charge initiale, un revêtement d’oxyde de nickel se forme sur l’électrode de nickel.
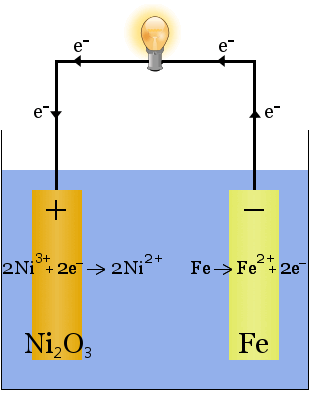
L’électrolyte (le liquide ionique entre les électrodes) est de 20 à 30% en poids d’hydroxyde de potassium dans l’eau.Le rôle de l’hydroxyde de potassium dans ce cas est d’augmenter la conductivité ionique pour compléter le circuit électrique – l’hydroxyde de potassium n’est pas consommé dans la réaction.
Lorsqu’elle se décharge, la cellule Edison fonctionne comme une cellule voltaïque.Lorsqu’elle est chargée, la cellule fonctionne comme une cellule électrolytique.
Les équations chimiques pour les réactions aux électrodes sont:
Pendant la décharge, lorsque la cellule délivre de l’énergie électrique, les réactions ci-dessus se déroulent à droite →.
Pendant la charge, lorsque la cellule convertit l’énergie électrique en énergie potentielle chimique, les réactions ci-dessus se déroulent vers la gauche ←.
La cellule Edison, avec les deux électrodes partageant le même électrolyte, est l’une des cellules voltaïques les plus simples en utilisation pratique; la plupart des cellules voltaïques sont plus compliquées.Ses grands avantages sont sa remarquable robustesse contre les erreurs telles que les surcharges et sa très longue durée de vie, avec un cycle charge-décharge presque illimité.
Son plus grand inconvénient est que, par rapport à sa production d’énergie, il est très lourd.
Autre exemple
Batteries au lithium
Les progrès de la technologie des batteries ont conduit à la miniaturisation des appareils électroniques.Sans ces avancées, les appareils modernes tels que les téléphones portables et les tablettes seraient plus gros et plus encombrants.
Au cœur de ces avancées se trouve la technologie lithium-ion.L’élément lithium est un métal de très faible densité : à 0,534 g/cm3 le lithium est moitié moins dense que l’eau; le lithium flotte sur l’eau.Comparez cela avec les métaux de la cellule Edison, la densité du nickel est de 8,908 g / cm3 et celle du fer est de 7,874 g / cm3: elles sont plus de 10 fois supérieures à la densité du lithium.
Le potentiel redox élevé du lithium combiné à sa faible densité rend ses ions parfaits pour une utilisation comme matériau de batterie.
Une batterie lithium-ion typique est basée sur des électrodes poreuses qui permettent aux ions Li de pénétrer et de sortir de leurs pores.Par example, une batterie lithium-ion rechargeable pourrait avoir une électrode en graphite et une électrode en oxyde de cobalt dopé au lithium avec un électrolyte polyoxyéthylène contenant le sel LiPF6.
Lorsqu’une telle batterie alimente un dispositif, les atomes de lithium maintenus dans la structure de couche de l’anode en graphite sont oxydés pour devenir des ions.
À la cathode, les ions lithium sont réduits dans la structure de l’oxyde de cobalt.
These reactions are reversed when the cell is being charged.
