La délocalisation se produit lorsque la charge électrique est répartie sur plus d’un atome. Par exemple, les électrons de liaison peuvent être répartis entre plusieurs atomes liés entre eux.

Exemple 1:
L’un des exemples les plus connus d’une molécule dans laquelle des électrons de liaison sont délocalisés est le benzène, illustré ci-dessous:
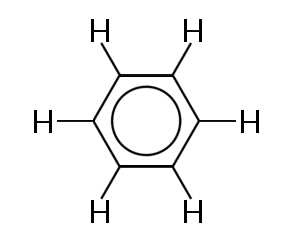
Le benzène est constitué d’un cycle de six atomes de carbone. Les atomes de carbone sont tous des sp2 hybridés avec une orbitale p non hybridée.
Les orbitales hybrides sp2 produisent des liaisons covalentes normales, parfois appelées liaisons σ : ce sont les liaisons C-C simples et les liaisons C-H simples.
Cela laisse à chaque carbone un électron dans une orbitale p à angle droit par rapport au plan de l’anneau.
Dans le diagramme ci-dessous, à gauche, vous pouvez voir les orbitales sp2 formant des liaisons covalentes. Sur la droite, vous pouvez voir les orbitales p, chacune contenant un électron.
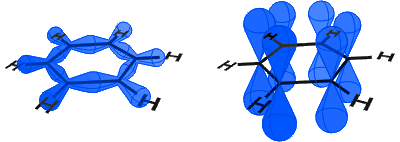
Les orbitales p se combinent de côté et les électrons dans les orbitales p sont décrits comme des électrons π.
Dans le diagramme ci-dessous, les orbitales p se sont combinées et les électrons π sont délocalisés. En moyenne, toutes les liaisons annulaires sont identiques.
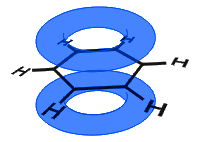
Contrairement à l’exemple suivant ci-dessous, les électrons délocalisés dans le benzène sont maintenus à l’intérieur de la molécule et ne sont pas libres de se déplacer à travers le matériau en vrac.
Exemple 2:
Les métaux ont une conductivité thermique et électrique élevée car les électrons les plus externes de leurs atomes sont délocalisés. Ces électrons ne sont associés à aucun noyau métallique particulier et sont donc libres de se déplacer dans tout le métal.
Reconnaissance: Les images de couleur bleue des orbitales du benzène sont une gracieuseté de Sansculotte. Ces images sont sous licence Creative Commons Attribution-Share Alike 1.0 Generic license.