Introduction
Les ressources fossiles sont la principale matière première pour l’énergie et les composés organiques, et leur utilisation entraîne l’émission de gaz à effet de serre associés au changement climatique. Le crash climatique à venir appelle une transition urgente d’une économie fossile à une économie biosourcée dans laquelle la biomasse lignocellulosique plutôt que le pétrole est utilisée pour la production de carburants, de produits chimiques et de matériaux. Le bois est une source importante de biomasse lignocellulosique; il est principalement composé de parois cellulaires épaissies secondaires riches en cellulose, hémicelluloses et lignine. Les trois polymères peuvent être valorisés dans l’économie biosourcée. La cellulose est une source pour l’industrie des pâtes et papiers, et la cellulose et les hémicelluloses peuvent être dépolymérisées en leurs monosaccharides pour être fermentées, par exemple, en bioéthanol, en acide lactique et en détergents (Vanholme et al., 2013b). Comme la lignine affecte négativement l’efficacité de la transformation du bois pour ces applications, les arbres peuvent être conçus pour accumuler moins de lignine, pour devenir plus aptes à la production de papier et de sucres fermentescibles. D’autre part, la lignine est de plus en plus considérée comme un composant précieux dans l’économie biosourcée. En effet, étant donné que la lignine est la plus grande source aromatique renouvelable sur Terre, la viabilité économique d’une bio-raffinerie peut être considérablement augmentée si la lignine est également valorisée et utilisée comme ressource pour la production de produits chimiques (Holladay et al., 2007; Tuck et coll., 2012; Davis et coll., 2013; Ragauskas et coll., 2014; Li C. et coll., 2015; Van den Bosch et coll., 2015; Rinaldi et coll., 2016; Upton et Kasko, 2016; Schutyser et coll., 2018).
Le polymère de lignine est composé de monolignols qui sont produits par les voies biosynthétiques du phénylpropanoïde et du monolignol, par une série de réactions enzymatiques commençant par la désamination de la phénylalanine (Figure 1). Les monolignols sont synthétisés dans le cytoplasme et translocés vers l’apoplaste, où ils sont déshydrogénés en radicaux monolignols par l’action des laccases et des peroxydases (Berthet et al., 2011; Zhao et coll., 2013). Ces radicaux monolignols se couplent ensuite les uns aux autres de manière combinatoire, générant une gamme de liaisons chimiques telles que la liaison aryl-éther (β-O-4), la liaison résinol (β-β) et la liaison phénylcoumarane (β-5) (Boerjan et al., 2003; Ralph et coll., 2004; Vanholme et coll., 2010). Les monolignols les plus courants sont les alcools hydroxycinnamyliques p-coumaryle, coniféryle et sinapyle, qui génèrent les unités H, G et S lors de leur incorporation dans le polymère de lignine, respectivement (Bonawitz et Chapple, 2010; Ralph et al., 2019; Vanholme et coll., 2019). La contribution relative des blocs constitutifs de la lignine varie selon les taxons, le stade de développement, le type de tissu et de cellule et même la couche de paroi cellulaire; la lignine des résineux (gymnospermes) est composée presque entièrement d’unités G avec une fraction mineure d’unités H, tandis que la lignine des feuillus (angiospermes) a des unités S en plus des unités G et des traces d’unités H (Boerjan et al., 2003; Vanholme et coll., 2010, 2019). Outre ces monolignols traditionnels, une variété d’autres molécules aromatiques p-hydroxylées peuvent être incorporées dans le polymère de lignine à différents niveaux (Vanholme et al., 2019).
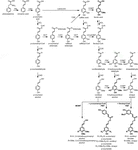
Figure 1. Lignin biosynthetic pathway. Alternative monomers and heterologously expressed enzymes are shown in bold. PAL, phenylalanine ammonia-lyase; C4H, cinnamate 4-hydroxylase; 4CL, 4-coumarate:CoA ligase; HCT, p-Hydroxycinnamoyl-CoA:quinate/shikimate-p-hydroxycinnamoyltransferase; C3’H, p-coumaroyl quinate/shikimate 3’-hydroxylase; CSE, caffeoyl shikimate esterase; CCoAOMT, caffeoyl-CoA O-methyltransferase; CCR, cinnamoyl-CoA reductase; F5H, ferulate 5-hydroxylase/CAld5H, coniferaldehyde 5-hydroxylase; COMT, acide caféique O-méthyltransférase; CAD, alcool cinnamylique déshydrogénase; FMT, monolignol transférase féruloyl-CoA; PMT, monolignol transférase p-coumaroyl-CoA.
Étant donné que la lignine est un facteur de récalcitrance majeur dans les processus de délignification du bois, de grands efforts de recherche ont été consacrés à démêler la voie de biosynthèse de la lignine et à étudier les effets des perturbations des gènes de biosynthèse de la lignine sur la quantité et la composition de la lignine et sur l’efficacité de la transformation du bois. Alors que des modifications dans des gènes allant de ceux codant pour les facteurs de transcription à ceux codant pour les enzymes oxydatives ont entraîné une modification de la teneur, de la composition ou du dépôt de lignine (Eriksson et al., 2000; Li Y.H. et coll., 2003; Liang et coll., 2008; Lu et coll., 2013; Lin et coll., 2016; Xu et coll., 2017; Yang et coll., 2017; Obudulu et coll., 2018), cette revue se concentrera sur les résultats obtenus par l’ingénierie des gènes biosynthétiques de la lignine.
Ingénierie de la voie de la lignine
Le tableau 1 donne un aperçu des différentes études sur les gènes biosynthétiques de la lignine régulés à la baisse ou mutés chez le peuplier, le pin, l’eucalyptus et le bouleau, avec les effets qui en résultent sur l’efficacité de la transformation du bois, une fois déterminés. La réduction de l’activité de n’importe quelle étape de la voie de biosynthèse de la lignine, à partir de PAL jusqu’à CAD, peut entraîner une réduction de la teneur en lignine (tableau 1). Plusieurs paramètres influencent le degré de réduction de la lignine, tels que le gène cible et le degré de régulation négative de l’activité enzymatique, qui dépend à son tour de l’efficacité de la construction de silençage utilisée, de la taille de la famille de gènes et de la redondance au sein de la famille de gènes. Généralement, la régulation à la baisse des étapes de C4H jusqu’à CCR entraîne une réduction plus spectaculaire de la quantité de lignine (Hu et al., 1999; Meyermans et coll., 2000; Zhong et coll., 2000; Li L. et coll., 2003; Jia et coll., 2004; Lu et coll., 2004; Leplé et coll., 2007; Coleman et coll., 2008a, b; Bjurhager et coll., 2010; Mansfield et coll., 2012; Ralph et coll., 2012; Min et coll., 2014; Van Acker et coll., 2014; Zhou et coll., 2015, 2018; Saleme et coll., 2017; Xiang et coll., 2017) que la réglementation à la baisse de F5H, COMT et CAD (Van Doorsselaere et al., 1995; Baucher et coll., 1996; Lapierre et coll., 1999; Jouanin et coll., 2000; Van Acker et coll., 2014; Wang et coll., 2018). La réduction de la lignine peut être associée à une augmentation de S/G, comme dans C3’H- (Coleman et al., 2008a; Ralph et coll., 2012) et CCoAOMT – arbres réglementés à la baisse (Meyermans et al., 2000), ou une diminution du rapport S/G comme dans CSE- (Saleme et al., 2017), et des arbres réglementés à la baisse (Van Doorsselaere et al., 1995; Lapierre et coll., 1999; Jouanin et coll., 2000). Il est intéressant de noter que les peupliers à faible teneur en lignine 4CL régulés à la baisse ont une augmentation de S/G (Min et al., 2014; Xiang et coll., 2017), une diminution de S/G (Voelker et al., 2010; Zhou et coll., 2015), ou des ratios comparables au type sauvage (Hu et al., 1999; Li L. et coll., 2003). Cette variance ne peut pas être associée au promoteur ou à la méthode utilisée pour la régulation négative, ce qui suggère que les différences dans le degré de silence, les conditions de croissance ou l’état de développement influencent ce trait. D’autre part, les effets les plus forts sur la composition en lignine H /G /S ont été observés chez les arbres régulés à la baisse en C3’H et HCT, qui déposent de la lignine avec une forte augmentation de la teneur en unités H (Coleman et al., 2008a; Ralph et coll., 2012; Vanholme et coll., 2013a), alors que les arbres qui surexpriment le F5H produisent de la lignine fortement enrichie en unités S (Franke et al., 2000; Li L. et coll., 2003; Stewart et coll., 2009), et les arbres qui sont réglementés à la baisse dans le COMT ont considérablement réduit la biosynthèse des unités S (Van Doorsselaere et al., 1995; Lapierre et coll., 1999).

Tableau 1. Vue d’ensemble des arbres forestiers avec expression modifiée des gènes de biosynthèse de la lignine.
L’efficacité de traitement de la biomasse peut également être modifiée par l’incorporation accrue de molécules qui représentent généralement des composants mineurs dans la lignine des plantes sauvages. L’incorporation d’acide férulique dans des arbres déficients en CCR entraîne la formation de liaisons acétales dans le polymère de lignine, qui sont facilement clivées dans les prétraitements de biomasse acide (Leplé et al., 2007; Ralph et coll., 2008; Van Acker et coll., 2014). En effet, les niveaux d’acide férulique dans la lignine sont en corrélation positive avec une efficacité de saccharification plus élevée (Van Acker et al., 2014). L’incorporation de l’alcool 5-hydroxyconiférylique et du 5-hydroxyconiféraldéhyde dans la lignine des peupliers déficients en COMT (Van Doorsselaere et al., 1995; Lapierre et coll., 1999; Jouanin et coll., 2000; Morreel et coll., 2004; Lu et coll., 2010) donnent lieu à des liaisons benzodioxanes, empêchant potentiellement les liaisons covalentes entre la lignine et les groupes hydroxyles polysaccharidiques (Weng et al., 2010; Vanholme et coll., 2012; Nishimura et coll., 2018). D’autre part, le déficit en COMT entraîne également une lignine plus condensée en raison des niveaux relativement plus élevés des liaisons β-β et β-5 condensées, et des niveaux plus faibles des liaisons β-O-4, lorsque la fréquence unitaire S baisse. La réduction en pâte chimique du bois issu de peupliers fortement régulée à la baisse pour le COMT a entraîné un rendement en pâte plus élevé, contrebalancé par la teneur résiduelle en lignine dans la pâte. Ces arbres avaient une teneur en lignine plus faible et une teneur en cellulose plus élevée (Jouanin et al., 2000). D’autre part, les peupliers qui étaient modérément réglementés à la baisse pour le COMT présentaient une forte diminution du rendement en pâte, probablement parce que la teneur en lignine était restée normale alors que la lignine avait une fréquence plus élevée de liaisons condensées qui affectaient négativement l’extraction de la lignine (Lapierre et al., 1999; Pilate et coll., 2002). L’incorporation de cinnamaldéhydes dans le polymère de lignine chez les arbres déficients en CAD entraîne des chaînes polymères de lignine plus courtes, d’où une proportion plus élevée de groupes terminaux phénoliques libres qui augmentent la solubilité du polymère dans les alcalis. L’incorporation de cinnamaldéhydes dans le polymère de lignine réduit vraisemblablement également l’interaction covalente de la chaîne aliphatique avec l’hémicellulose, rendant à nouveau la lignine plus soluble. De plus, en raison du système conjugué étendu qui est généré lorsqu’un cinnamaldéhyde β-O-4 se couple avec un autre monomère, la liaison éther aromatique du cinnamaldéhyde incorporé devient plus sensible au clivage alcalin (Lapierre et al., 1989; Van Acker et coll., 2017).
La polymérisation de la lignine est un processus de couplage radicalaire combinatoire, permettant d’incorporer naturellement une large gamme de composés phénoliques dans le polymère de la lignine (Boerjan et al., 2003; Vanholme et coll., 2019). Les chercheurs ont tenté d’adapter la quantité et la composition de lignine pour améliorer le traitement de la biomasse par expression de gènes hétérologues, en visant la biosynthèse et l’incorporation de divers composés phénoliques compatibles en tant que monolignols alternatifs dans le polymère de lignine (Ralph, 2006; Vanholme et al., 2012; Mottiar et coll., 2016; Mahon et Mansfield, 2018). Un exemple est l’introduction de gènes codant des enzymes nécessaires à la biosynthèse des unités S chez le pin; l’expression simultanée des unités F5H, COMT et CAD introduites avec succès chez Pinus radiata (Wagner et al., 2015; Edmunds et coll., 2017). L’introduction du gène codant pour une monolignol 4-O-méthyltransférase (MOMT4) dans le peuplier conduit à la formation d’alcools de coniféryle et de sinapyle 4-O-méthylés, qui ne peuvent pas être incorporés dans le polymère de lignine en croissance car ils ne possèdent pas le groupe hydroxyle aromatique. Cela conduit à un arrêt de la polymérisation de la lignine et aboutit à des arbres à faible teneur en lignine et à une efficacité de saccharification plus élevée (Bhuiya et Liu, 2010; Cai et al., 2016). Les peupliers ont également été conçus pour contenir des liaisons ester dans le squelette du polymère de lignine. Des esters de ferulate de coniféryle ont été introduits dans le polymère par l’expression d’un gène FERULOYL-CoA: MONOLIGNOL TRANSFÉRASE (FMT) dérivé d’Angelica sinensis (Wilkerson et al., 2014), conduisant à une efficacité de saccharification améliorée dans diverses conditions de prétraitement (Wilkerson et al., 2014; Kim et coll., 2017; Bhalla et coll., 2018), et une efficacité améliorée de la pâte kraft par rapport au type sauvage (Zhou et al., 2017). Des esters de p-coumarate de monolignol ont également été conçus chez le peuplier, via l’expression d’un gène p-COUMAROYL-CoA: MONOLIGNOL TRANSFÉRASE (PMT) de riz, ce qui entraîne une fréquence plus élevée de liaisons interunitaires résistantes et une fréquence plus élevée d’unités terminales G et S avec des groupes phénoliques libres (Smith et al., 2015; Sibout et coll., 2016). Alors que chez Arabidopsis, l’expression hétérologue de la PMT a entraîné une diminution de la quantité de lignine accompagnée d’une efficacité accrue de la saccharification (Sibout et al., 2016), il n’y a pas eu de diminution de la quantité de lignine dans le peuplier et l’efficacité de la saccharification n’a pas été déterminée (Smith et al., 2015).
Bien qu’il ait été démontré que plusieurs modifications de la quantité et de la composition de la lignine apportaient des améliorations dans le traitement de la biomasse, ces modifications étaient souvent accompagnées d’une pénalité de rendement en biomasse (Leplé et al., 2007; Wadenbäck et coll., 2008; Wagner et coll., 2009; Voelker et coll., 2010; Stout et coll., 2014; Van Acker et coll., 2014; Sykes et coll., 2015; Zhou et coll., 2018). Une métasturgie récente a perturbé 21 gènes de biosynthèse de la lignine chez P. trichocarpa, et a intégré de manière exhaustive les résultats de données transcriptomiques, protéomiques, fluxomiques et phénoménales de 221 lignées. Les auteurs ont conclu que la croissance des arbres n’est pas associée à la quantité de lignine, à la composition des sous-unités ou à des liens spécifiques (Wang et al., 2018), mais plutôt corrélée à la présence de vaisseaux xylémiques effondrés (Coleman et al., 2008a, b; Wagner et coll., 2009; Voelker et coll., 2010; Vargas et coll., 2016; De Meester et coll., 2018), l’activation d’une voie d’intégrité de la paroi cellulaire (Bonawitz et al., 2014) et/ou l’accumulation d’inhibiteurs chimiques (Gallego-Giraldo et al., 2011; Muro-Villanueva et coll., 2019).
Alors que des efforts substantiels ont été faits pour diminuer la teneur en lignine par une régulation à la baisse des gènes biosynthétiques de la lignine, les études sur la régulation à la hausse de la voie de la lignine et la surproduction de lignine ont été rares. En effet, les rapports sur la surexpression de F5H montrent une teneur en lignine inchangée voire diminuée (Huntley et al., 2003; Li L. et coll., 2003; Stewart et coll., 2009; Mansfield et coll., 2012; Edmunds et coll., 2017). La surexpression de la CAD et de la COMT a entraîné un silençage génétique plutôt qu’une régulation à la hausse, ou aucun effet sur les niveaux d’expression n’a été détecté (Baucher et al., 1996; Lapierre et coll., 1999; Jouanin et coll., 2000; Leplé et coll., 2007; Van Acker et coll., 2014). La surexpression des facteurs de transcription R2R3-MYB PtoMYB92, PtoMYB216 et PtoMYB74 a tous entraîné des couches de xylème supplémentaires, des parois cellulaires de xylème plus épaisses ainsi qu’un dépôt de lignine ectopique, et les plantes ont accumulé 13 à 50% de lignine en plus (Tian Q. et al., 2013; Li C.F. et coll., 2015; Li et coll., 2018). Les lignées de surexpression de MYB ont régulé de manière constitutive les gènes de la voie de biosynthèse de la lignine, et alors que les plantes surexpressant MYB92 et MYB74 avaient une pénalité de biomasse, la surexpression de MYB216 a entraîné des plantes avec jusqu’à 50% de lignine en plus et aucun phénotype de développement. La lignine étant de plus en plus considérée comme une ressource importante pour la production durable de produits chimiques (Cao et al., 2018) l’ingénierie des usines de surproduction de lignine devrait être explorée plus avant.
Essais sur le terrain
Les exemples présentés ci-dessus montrent clairement que l’ingénierie de la lignine via une régulation descendante ou supérieure des gènes de la voie phénylpropanoïde – ou l’expression de gènes hétérologues – a le potentiel d’augmenter l’efficacité de traitement de la biomasse lignocellulosique. Pour des raisons pratiques et réglementaires, la plupart des études font état de données obtenues à partir de l’analyse d’arbres cultivés en serre. Cependant, les expériences avec des arbres cultivés en serre ne tiennent généralement pas compte des processus de développement tels que la cessation de la croissance et la dormance. De plus, les expériences en serre ne fournissent pas suffisamment d’informations sur l’interaction de la plante modifiée avec des facteurs environnementaux tels que le type de sol, le vent et les agents pathogènes. La compréhension de ces interactions est une étape importante dans la traduction des résultats de recherche vers des applications commerciales. En effet, l’ensemble des travaux produits par les études pour lesquelles l’autorisation d’effectuer des essais sur le terrain a été accordée met en évidence d’importantes différences de phénotype entre les arbres cultivés en serre et les arbres cultivés en plein champ. Le tableau 1 résume les rapports sur les essais sur le terrain effectués avec des arbres réglementés à la baisse par 4CL, CCoAOMT, CCR, COMT et CAD.
Confirmant le potentiel de la biomasse lignocellulosique modifiée comme substrat pour des applications, plusieurs arbres cultivés sur le terrain à la lignine ont montré des améliorations dans la transformation du bois. Les peupliers soumis à une régulation négative pour le CCoAOMT cultivé pendant 5 ans lors d’un essai au champ à Beijing (Chine) ont montré une augmentation de la libération de glucose et de xylose lors de la saccharification (Wang et al., 2012). Les peupliers réglementés à la baisse pour le CCR et cultivés dans un essai au champ en France se sont révélés plus propices à la pâte kraft chimique (Leplé et al., 2007). Deux essais sur le terrain supplémentaires menés en France et en Belgique avec des peupliers à régulation négative du CCR ont permis d’améliorer jusqu’à 160% la production d’éthanol lors d’essais simultanés de saccharification et de fermentation (SSF); cependant, les plantes ont réduit la biomasse jusqu’à 50% (Van Acker et al., 2014). Des essais sur le terrain avec du peuplier CAD régulé à la baisse ont également montré des résultats prometteurs. Ces arbres présentaient un peu moins de lignine que le type sauvage et se prêtaient mieux à la délignification kraft (Lapierre et al., 1999). De façon constante, les mêmes lignées cultivées dans des essais au champ à plus grande échelle en France et au Royaume-Uni ont montré une légère diminution de la quantité de lignine et une amélioration de la pâte kraft jugée commercialement pertinente, car les plantes avaient besoin de 6% d’alcali en moins pour obtenir une délignification similaire à celle des arbres de type sauvage (Pilate et al., 2002).
Cependant, des rapports contradictoires sur le rendement de la biomasse et l’efficacité du traitement en aval suggèrent que ces paramètres sont fortement influencés par des facteurs environnementaux. Alors qu’un essai au champ mené en Chine avec des peupliers à régulation négative de 4CL a révélé que, même avec une diminution de 28% de la teneur en lignine par rapport au type sauvage, les arbres avaient une hauteur accrue d’environ 8% (Tian X.M. et al., 2013), en accord avec les études sur les serres (Hu et al., 1999), d’autres essais sur le terrain ont révélé que les peupliers à régulation négative de 4CL avaient une biomasse réduite et étaient parfois même nains (Voelker et al., 2010; Stout et coll., 2014; Marchin et coll., 2017). Les rapports divergent également quant à l’efficacité de traitement en aval du bois dérivé de ces peupliers cultivés en plein champ réglementés à la baisse de 4CL. Alors que jusqu’à 100% d’augmentation de la récupération du sucre a été trouvée pour les arbres 4CL1-à régulation descendante (construction antisens 4CL à entraînement 35S) cultivés dans un site de montagne aux États-Unis (Xiang et al., 2017), les données obtenues à partir d’études de terrain menées en Oregon (États-Unis) ont révélé que les peupliers 4CL1 silencieux antisens entraînés par le promoteur Pt4CL1 n’avaient aucune amélioration de l’efficacité de la saccharification par rapport au type sauvage (Voelker et al., 2010). De même, une étude à long terme à Wenling (Chine) a révélé que les peupliers à 4CL régulés à la baisse ne présentaient pas d’amélioration significative du rendement en sucre par rapport au type sauvage (Wang et al., 2012). Dans les deux derniers cas, les arbres ont montré de légères diminutions de la quantité de lignine qui ne se sont pas traduites par une efficacité de traitement plus élevée, potentiellement en raison de la concentration plus élevée d’extraits susceptibles d’interférer avec l’activité enzymatique (Voelker et al., 2010).
Des études sur le terrain ont montré que des facteurs environnementaux peuvent influencer la lignification et restaurer les caractères à des niveaux de type sauvage par rapport aux niveaux atteints lorsque les mêmes plantes ont été cultivées en serre. Alors que les arbres réglementés à la baisse de 4CL avaient une teneur en lignine réduite lorsqu’ils étaient cultivés en serre, l’analyse des mêmes peupliers antisens de 4CL, mais cultivés au champ, a souvent montré que la teneur en lignine était augmentée par rapport aux arbres cultivés en serre et parfois même ramenée à des niveaux de type sauvage (Stout et al., 2014; Xiang et coll., 2017). De même, les niveaux de lignine étaient beaucoup moins réduits chez les peupliers déficients en CCR lorsqu’ils étaient cultivés au champ que lorsqu’ils étaient cultivés en serre (Van Acker et al., 2014). Au moins pour les peupliers déficients en CCR, il est possible que le niveau de lignification plus élevé des arbres cultivés au champ soit dû au fait que les échantillons de bois ont été prélevés pendant l’hiver. Lorsque la croissance des arbres cesse en automne, les arbres ont encore le temps de lignifier complètement leurs parois cellulaires au moment où l’arbre entre en dormance, par rapport aux arbres cultivés en serre qui développent un nouveau xylème en continu. Il a également été démontré que la composition de la lignine diffère entre les arbres à faible teneur en lignine cultivés en serre et en plein champ. 4CL – peupliers réglementés à la baisse cultivés dans un champ en Caroline du Nord avaient une lignine avec un S / G plus faible que lorsque les mêmes lignées étaient cultivées en serre (Stout et al., 2014).
Pris ensemble, ces résultats montrent que les données obtenues à partir d’arbres cultivés en serre ne peuvent pas être facilement extrapolées aux arbres cultivés au champ, ce qui sous-tend la nécessité d’expériences d’essais sur le terrain à différents endroits. Certaines lignes présentaient une pénalité de rendement les rendant moins intéressantes pour les applications, soulignant la nécessité d’une meilleure compréhension de la base moléculaire de la pénalité de rendement et du développement de stratégies pour surmonter ce problème.
Il a été démontré que la lignine joue un rôle important dans la résistance aux agents pathogènes (Miedes et al., 2014; Zhao et Dixon, 2014), et il joue un rôle central en permettant à l’usine de transporter de l’eau. Cela suggère que les modifications de la lignine pourraient avoir un impact sur la tolérance au stress des plantes. Bien qu’une étude plus approfondie soit nécessaire pour aborder pleinement cette possibilité, la régulation à la baisse de 4CL, de COMT et de CAD chez le peuplier n’a pas modifié de manière spectaculaire la performance alimentaire des herbivores se nourrissant de feuilles (Tiimonen et al., 2005; Brodeur-Campbell et coll., 2006; Hjalten et coll., 2013). L’effet de la régulation à la baisse du COMT et du CAD chez le peuplier sur les interactions plantes-insectes a également été évalué sur les arbres cultivés en plein champ, et il a été démontré que les arbres modifiés à la lignine avaient une incidence normale de visite et d’alimentation des insectes, ainsi que des réponses normales aux agents pathogènes microbiens (Pilate et al., 2002; Halpin et coll., 2007). Ces résultats indiquent que les arbres contenant de la lignine modifiée ne souffrent pas nécessairement plus que les plantes de type sauvage des ravageurs et des maladies. Néanmoins, le profilage du microbiome bactérien de l’endosphère du bois récolté à partir de peupliers cultivés en plein champ et réglementés par le CCR a montré des changements dans la communauté bactérienne, probablement en raison de l’abondance modifiée de métabolites phénoliques particuliers dans le xylème (Beckers et al., 2017).
Compte tenu du rôle de la lignine dans la fonction et la structure du xylème, les relations hydriques de quelques peupliers faiblement modifiés en lignine ont été évaluées. On a constaté que les peupliers à régulation descendante de 4CL avaient une conductivité hydraulique réduite, ce qui pourrait nuire à la croissance des plantes (Marchin et al., 2017). Des expériences de contraintes hydrauliques avec des peupliers régulés à la baisse pour le CCR, le COMT ou le CAD ont montré que ces plantes avaient une plus faible résistance à la cavitation, tout en maintenant une conductivité hydraulique normale du xylème et un transport de l’eau (Awad et al., 2012). Ces résultats suggèrent que la croissance des mutants à faible teneur en lignine pourrait être influencée par la disponibilité en eau. Comme pour tout nouvel hybride issu de la sélection classique, des tests sur le terrain sont nécessaires pour évaluer la performance sur le terrain et la tolérance au stress des arbres issus de l’ingénierie à la lignine.
Perspectives d’ingénierie de la lignine dans les arbres forestiers
Les performances des plantes issues de l’ingénierie de la lignine semblent fortement influencées par les conditions environnementales. Il n’est cependant pas clair si les différences observées entre les arbres cultivés en serre et les arbres cultivés au champ, ou entre les arbres cultivés à différents endroits sur le terrain, résultent de différents niveaux de suppression des gènes ou de l’interaction du caractère modifié avec l’environnement (GxE). En effet, une régulation négative instable est une lacune des techniques de silençage génique basées sur l’ARNi. Ceci est attesté par l’observation de la variation du phénotype du xylème rouge qui est observée lorsque des gènes particuliers de biosynthèse de la lignine, tels que CAD, COMT ou CCR, sont régulés à la baisse. La coloration rouge du xylème n’est souvent pas uniforme dans tout le xylème, mais apparaît plutôt dans des taches qui reflètent des niveaux variables de silençage génique (Leplé et al., 2007; Voelker et coll., 2010; Van Acker et coll., 2014; Figure 2). En outre, l’utilisation de méthodes de silençage génique peut potentiellement entraîner un silençage concomitant de membres de familles de gènes étroitement apparentés – peut–être à divers degrés – obscurcissant les interprétations et camouflant les effets de la régulation négative des gènes individuels.

Figure 2. Régulation à la baisse des gènes par ARNi. Phénotype de xylème rouge inégal observé sur des troncs de peupliers déficients en CCR (à droite) cultivés lors d’un essai au champ en Belgique. Le xylème rouge indique les zones de régulation négative du CCR. Le bois des arbres sauvages est blanchâtre (à gauche).
Ces problèmes peuvent maintenant être facilement surmontés grâce à l’utilisation de technologies d’édition de gènes basées sur CRISPR qui permettent des mutations stables de perte de fonction (knock-out) dans des gènes cibles spécifiques, permettant la dissection de la fonction de gènes individuels au sein de familles. Par exemple, le ciblage de membres individuels de la famille du gène 4CL chez le peuplier a montré que 4CL1 est lié à la lignification, alors que 4CL2 est impliqué dans la production de proanthocyanidine (Zhou et al., 2015). En plus des allèles knock-out, l’édition génétique à base de CRISPR permet également de créer de nouveaux allèles conférant une réduction partielle de l’activité enzymatique. Cela ouvre la possibilité d’affiner le niveau d’activité enzymatique résiduelle et de contourner la pénalité de rendement souvent observée lorsque la quantité de lignine descend en dessous d’un seuil. Une autre voie prometteuse pour l’ingénierie de la lignine dans les arbres forestiers rendue possible grâce à l’ingénierie génomique basée sur CRISPR est l’édition simultanée de plusieurs gènes (empilement d’allèles) pour optimiser l’efficacité du traitement de la biomasse, comme illustré dans Arabidopsis où l’empilement des mutations transaldolase (tra) et comt, des mutations c4h et comt, ou des mutations 4cl et comt a entraîné des améliorations additives et synergiques de l’efficacité de la saccharification (de Vries et al., 2018). En effet, une approche systémique en P. trichocarpa prédit que la régulation à la baisse concomitante du PAL et du CCoAOMT, ou du PAL, du C3’H et du CCOAOMT améliorera considérablement les propriétés du bois et la libération de sucre (Wang et al., 2018).
L’utilisation de l’édition du génome à base de CRISPR dans l’amélioration des arbres pour les industries des pâtes et papiers et de la bio-raffinerie, ainsi que pour la production d’aromatiques de plate-forme à partir de la dégradation hydrogénolytique de la lignine, sera très utile lorsque cette technologie sera combinée stratégiquement avec d’autres techniques de sélection (figure 3). En effet, une grande variation de la quantité de lignine et de la composition en S/G existe déjà dans les populations naturelles d’arbres forestiers (Studer et al., 2011). Étant donné que les deux caractères affectent la libération de glucose lors de la saccharification (Yoo et al., 2018), exploitant cette diversité génétique par la sélection conventionnelle, aidée par des études d’association à l’échelle du génome (GWAS) (Porth et al., 2013; Fahrenkrog et al., 2017; Liu et coll., 2018), Se reproduisant avec des Allèles Défectueux Rares (BRDA) (Vanholme et al., 2013a) ou la sélection génomique (Yin et al., 2010; Muchero et coll., 2015; Pawar et coll., 2018; Xie et coll., 2018), est une stratégie précieuse pour obtenir des lignes qui ont amélioré l’efficacité de la transformation du bois. Une fois que les arbres d’élite sont obtenus par ces méthodes de sélection, le génie génétique et l’édition génétique de gènes spécifiques basée sur CRISPR sont une avenue très prometteuse pour améliorer davantage ces génotypes d’élite sans rompre leur constitution génétique et sans passer par de longs cycles de sélection. Compte tenu du crash climatique imminent, nous n’avons plus de temps à perdre à adopter ces nouvelles techniques d’élevage dans notre course à l’économie biosourcée.
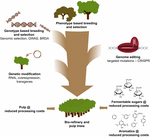
Figure 3. Amélioration génétique des arbres forestiers grâce à une combinaison d’outils de sélection. Pour accélérer l’amélioration génétique des arbres forestiers pour les applications de pâte à papier et de bioraffinerie, les outils de sélection classiques et nouveaux doivent être combinés intelligemment. La sélection classique implique une sélection phénotypique des arbres pour des croisements contrôlés, suivie d’une sélection phénotypique. Avec l’avènement de l’information sur la séquence du génome de nombreux arbres forestiers, de nouvelles stratégies telles que la Sélection génomique, les Études d’Association à l’échelle du génome (GWA) et la sélection avec des Allèles Défectueux rares (BRDA) ont été développées pour accélérer la capture et l’enrichissement des polymorphismes d’ADN associés à des traits bénéfiques. L’édition du génome basée sur CRISPR permet de modifier le génome d’une manière qui imite les polymorphismes naturels. La modification génétique implique l’intégration stable d’ADN étranger dans l’arbre pour surproduire (une) enzyme (s) ou réguler à la baisse (un) gène (s). La combinaison des techniques d’élevage classiques et nouvelles est nécessaire pour fournir suffisamment de bois de haute qualité à la société.
Contributions des auteurs
Tous les auteurs énumérés ont apporté une contribution substantielle, directe et intellectuelle à l’œuvre et l’ont approuvée pour publication.
Financement
Nous reconnaissons un financement partiel du projet IWT-SBO BIOLEUM (Subvention n ° 130039), et par SBO-FISH à travers le projet ARBOREF. AC a reçu un financement de la FWO et du Programme de Recherche et d’innovation Horizon 2020 de l’Union Européenne dans le cadre de la Convention de subvention Marie Skłodowska-Curie n ° 665501. LdV a été financé par l’Institut pour la promotion de l’Innovation par la Science et la Technologie en Flandre (IWT-Vlaanderen) pour une bourse prédoctorale.
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Annick Bleys d’avoir préparé ce manuscrit pour soumission.
Boerjan, W., Ralph, J. et Baucher, M. (2003). Biosynthèse de la lignine. Annu. Rév. Plante Biol. 54, 519–546.
Résumé publié par Google Scholar
Lapierre, C., Pollet, B., Petit-Conil, M., Toval, G., Romero, J., Pilate, G., et al. (1999). Les altérations structurelles des lignines dans les peupliers transgéniques avec une activité réduite de l’alcool cinnamylique déshydrogénase ou de l’acide caféique O-méthyltransférase ont un impact inverse sur l’efficacité de la pâte kraft industrielle. Physiol végétal. 119, 153–163.
Résumé PubMed/Google Scholar
Ralph, J. (2006). « Qu’est-ce qui fait un bon substitut de monolignol?, « in The Science and Lore of the Plant Cell Wall – Biosynthesis, Structure and Function, ed. T. Hayashi (Boca Raton, FL : BrownWalker Press).
Google Scholar