Nom générique: héparine sodique
Forme posologique: injection
- Hep-Lock Description
- Hep-Lock – Pharmacologie clinique
- Indications et utilisation pour Hep-Lock
- Contre-indications
- Avertissements
- Hypersensibilité
- Hémorragie
- Thrombocytopénie
- La thrombocytopénie induite par l’héparine (HIT) et la thrombocytopénie et la thrombose induites par l’héparine (HITT)
- Une thrombocytopénie induite par l’héparine et une thrombocytopénie et une thrombose induites par l’héparine peuvent survenir jusqu’à plusieurs semaines après l’arrêt du traitement par héparine. Les patients présentant une thrombocytopénie ou une thrombose après l’arrêt du traitement par l’héparine doivent être évalués pour le HIT et le HITT. Utilisation chez les nouveau-nés et les nourrissons
- Précautions
- Généralités
- Tests de laboratoire
- Interactions médicamenteuses
- Carcinogenèse, Mutagénèse, Altération de la fertilité
- Grossesse
- Grossesse Catégorie C
- Mères allaitantes
- Utilisation pédiatrique
- Utilisation gériatrique
- Effets indésirables
- Hémorragie
- Thrombocytopénie, Thrombocytopénie induite par l’héparine (HIT) et Thrombocytopénie et Thrombose induites par l’héparine (HITT) et Apparition retardée de HIT et HITT
- Irritation locale
- Hypersensibilité
- Surdosage
- Symptômes
- Traitement – Neutralisation de l’effet de l’héparine
- Dosage et administration de Hep-Lock
- Maintien de la Perméabilité des Dispositifs Intraveineux
- Prélèvement d’Échantillons de sang
- Comment est fourni Hep-Lock
- Stockage
Hep-Lock Description
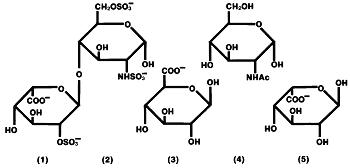
L’héparine est un groupe hétérogène de mucopolysaccharides anioniques à chaîne droite, appelés glycosaminoglycanes, ayant des propriétés anticoagulantes. Bien que d’autres puissent être présents, les principaux sucres présents dans l’héparine sont: (1) acide α-L-iduronique 2-sulfate, (2) 2-désoxy-2-sulfamino-α-D-glucose 6-sulfate, (3) acide β-D-glucuronique, (4) 2-acétamido-2-désoxy-α-D-glucose et (5) acide α-L-iduronique. Ces sucres sont présents en quantités décroissantes, généralement dans l’ordre (2) >>>> (5), et sont reliés par des liaisons glycosidiques, formant des polymères de différentes tailles. L’héparine est fortement acide en raison de sa teneur en groupes sulfate et acide carboxylique liés de manière covalente. Dans l’héparine sodique, les protons acides des unités sulfate sont partiellement remplacés par des ions sodium.
Formule structurale de l’héparine sodique (sous-unités représentatives):
Hep-Lock U / P (Solution de rinçage à l’héparine sans conservateur, USP) est une solution stérile pour rinçage intraveineux uniquement. Il ne doit pas être utilisé pour un traitement anticoagulant. Hep-Lock U / P est spécialement formulé pour une utilisation dans des situations où l’utilisation de conservateurs n’est pas recommandée. Chaque mL contient de l’héparine sodique 10 ou 100 unités USP, dérivées de l’intestin porcin et normalisées pour une utilisation comme anticoagulant, du chlorure de sodium 8 mg, du phosphate de sodium monobasique monohydraté 2,3 mg et du phosphate de sodium dibasique anhydre 0,5 mg dans de l’eau pour injection. pH 5,0-7.5. La puissance est déterminée par dosage biologique à l’aide d’un étalon de référence USP basé sur des unités d’activité de l’héparine par milligramme.
Hep-Lock – Pharmacologie clinique
L’héparine inhibe les réactions conduisant à la coagulation du sang et à la formation de caillots de fibrine in vitro et in vivo. L’héparine agit sur plusieurs sites du système de coagulation normal. De petites quantités d’héparine en association avec l’antithrombine III (cofacteur de l’héparine) peuvent inhiber la thrombose en inactivant le facteur X activé et en inhibant la conversion de la prothrombine en thrombine. Une fois la thrombose active développée, de plus grandes quantités d’héparine peuvent inhiber la coagulation en inactivant la thrombine et en empêchant la conversion du fibrinogène en fibrine. L’héparine empêche également la formation d’un caillot de fibrine stable en inhibant l’activation du facteur de stabilisation de la fibrine.
Le temps de saignement n’est généralement pas affecté par l’héparine. Le temps de coagulation est prolongé par des doses thérapeutiques complètes d’héparine; dans la plupart des cas, il n’est pas affecté de manière mesurable par de faibles doses d’héparine. Les diagrammes loglinéaires des concentrations plasmatiques d’héparine avec le temps, pour une large gamme de niveaux de dose, sont linéaires, ce qui suggère l’absence de processus d’ordre zéro. Le foie et le système réticulo-endothélial sont les sites de biotransformation. La courbe d’élimination biphasique, une phase alpha en déclin rapide (t½ = 10 min), et après l’âge de 40 ans une phase bêta plus lente, indique une absorption dans les organes. L’absence de relation entre la demi-vie anticoagulante et la demi-vie de concentration peut refléter des facteurs tels que la liaison protéique de l’héparine.
Les patients de plus de 60 ans, après des doses similaires d’héparine, peuvent présenter des taux plasmatiques d’héparine plus élevés et des temps de thromboplastine partielle activée (TPA) plus longs que les patients de moins de 60 ans.
L’héparine n’a pas d’activité fibrinolytique; par conséquent, elle ne lyse pas les caillots existants.
Indications et utilisation pour Hep-Lock
Hep-Lock U /P (Solution de rinçage à l’héparine sans conservateur, USP) est destiné à maintenir la perméabilité d’un dispositif de ponction veineuse à demeure conçu pour une injection intermittente ou un traitement par perfusion ou un prélèvement sanguin. La solution Héparine Lock Flush peut être utilisée après la mise en place initiale du dispositif dans la veine, après chaque injection d’un médicament ou après le prélèvement de sang pour des tests de laboratoire. (Voir POSOLOGIE ET ADMINISTRATION, Maintien de la Perméabilité des Dispositifs Intraveineux pour le mode d’emploi.)
Hep-Lock U/P ne doit pas être utilisé en traitement anticoagulant.
Contre-indications
L’héparine sodique ne doit PAS être utilisée chez les patients présentant les conditions suivantes: thrombocytopénie sévère; un état de saignement actif incontrôlable (voir MISES EN GARDE), sauf lorsque cela est dû à une coagulation intravasculaire disséminée.
Avertissements
L’héparine n’est pas destinée à une utilisation intramusculaire.
Hypersensibilité
Les patients présentant une hypersensibilité documentée à l’héparine ne doivent recevoir le médicament que dans des situations clairement potentiellement mortelles. (Voir EFFETS INDÉSIRABLES, Hypersensibilité.)
Hémorragie
Une hémorragie peut survenir à pratiquement n’importe quel site chez les patients recevant de l’héparine. Une chute inexpliquée de l’hématocrite, une chute de la pression artérielle ou tout autre symptôme inexpliqué devrait entraîner une prise en compte sérieuse d’un événement hémorragique.
L’héparine sodique doit être utilisée avec une extrême prudence dans les états pathologiques présentant un risque accru d’hémorragie. Certaines des conditions dans lesquelles il existe un risque accru d’hémorragie sont:
Endocardite bactérienne subaiguë cardiovasculaire
, hypertension sévère.
Chirurgie
Pendant et immédiatement après (a) une anesthésie rachidienne ou rachidienne ou (b) une intervention chirurgicale majeure, impliquant notamment le cerveau, la moelle épinière ou l’œil.
Conditions hématologiques
associées à des tendances hémorragiques accrues, telles que l’hémophilie, la thrombocytopénie et certains purpuras vasculaires.
Lésions ulcéreuses gastro-intestinales et drainage tubulaire continu de l’estomac ou de l’intestin grêle.Autres
Menstruations, maladie du foie avec hémostase altérée.
Thrombocytopénie
Une thrombocytopénie a été rapportée chez des patients recevant de l’héparine avec une incidence pouvant atteindre 30 %. La numération plaquettaire doit être obtenue au départ et périodiquement pendant l’administration d’héparine. Une thrombocytopénie légère (numération supérieure à 100 000/mm3) peut rester stable ou s’inverser même si l’héparine est maintenue. Cependant, la thrombocytopénie de tout degré doit être surveillée de près. Si le nombre tombe en dessous de 100 000 / mm3 ou si une thrombose récurrente se développe (voir Thrombocytopénie induite par l’héparine et Thrombocytopénie et thrombose induites par l’héparine), le produit à base d’héparine doit être arrêté et, si nécessaire, un anticoagulant alternatif doit être administré.
La thrombocytopénie induite par l’héparine (HIT) et la thrombocytopénie et la thrombose induites par l’héparine (HITT)
La thrombocytopénie induite par l’héparine (HIT) est une réaction grave médiée par les anticorps résultant d’une agrégation irréversible des plaquettes. La HIT peut évoluer vers le développement de thromboses veineuses et artérielles, une affection appelée thrombocytopénie et thrombose induites par l’héparine (HITT). Les événements thrombotiques peuvent également être la présentation initiale de HITT. Ces événements thromboemboliques graves comprennent une thrombose veineuse profonde, une embolie pulmonaire, une thrombose veineuse cérébrale, une ischémie des membres, un accident vasculaire cérébral, un infarctus du myocarde, une thrombose mésentérique, une thrombose artérielle rénale, une nécrose cutanée, une gangrène des extrémités pouvant entraîner une amputation et éventuellement la mort. La thrombocytopénie de tout degré doit être surveillée de près. Si la numération plaquettaire tombe en dessous de 100 000/mm3 ou si une thrombose récurrente se développe, le produit à base d’héparine doit être rapidement arrêté et d’autres anticoagulants doivent être envisagés si les patients ont besoin d’une anticoagulation continue.
Une thrombocytopénie induite par l’héparine et une thrombocytopénie et une thrombose induites par l’héparine peuvent survenir jusqu’à plusieurs semaines après l’arrêt du traitement par héparine. Les patients présentant une thrombocytopénie ou une thrombose après l’arrêt du traitement par l’héparine doivent être évalués pour le HIT et le HITT.
Utilisation chez les nouveau-nés et les nourrissons
La concentration de 100 unités / mL ne doit pas être utilisée chez les nouveau-nés ou chez les nourrissons pesant moins de 10 kg en raison du risque d’anticoagulation systémique. La prudence s’impose lors de l’utilisation de la concentration de 10 unités / mL chez les prématurés pesant moins de 1 kg et recevant des bouffées fréquentes, car une dose thérapeutique d’héparine peut être administrée au nourrisson dans un délai de 24 heures.
Précautions
Généralités
Des précautions doivent être prises lorsque des médicaments incompatibles avec l’héparine sont administrés par cathéter intraveineux à demeure contenant une solution de rinçage à l’héparine sans conservateur. (SEMIS ET ADMINISTRATION, Maintien de la perméabilité des Dispositifs Intraveineux.) La concentration de phosphore dans la solution d’héparine est de 0,63 mg / mL.
Thrombocytopénie, Thrombocytopénie induite par l’héparine (HIT) et Thrombocytopénie et Thrombose induites par l’héparine (HITT)
Voirvenances
Risque accru pour les patients âgés, en particulier les femmes
Une incidence plus élevée de saignements a été rapportée chez les patients, en particulier les femmes, âgés de plus de 60 ans.
Tests de laboratoire
La numération plaquettaire périodique, les hématocrites et les tests de sang occulte dans les selles sont recommandés pendant toute la durée du traitement par héparine, quelle que soit la voie d’administration. (Ensemencement ET ADMINISTRATION.)
Interactions médicamenteuses
Inhibiteurs plaquettaires
Des médicaments tels que l’acide acétylsalicylique, le dextrane, la phénylbutazone, l’ibuprofène, l’indométacine, le dipyridamole, l’hydroxychloroquine et d’autres qui interfèrent avec les réactions d’agrégation plaquettaire (principale défense hémostatique des patients héparinés) peuvent induire des saignements et doivent être utilisés avec prudence chez les patients recevant de l’héparine sodique.
Autres interactions
Les digitaliques, les tétracyclines, la nicotine ou les antihistaminiques peuvent partiellement contrecarrer l’action anticoagulante de l’héparine sodique.
Carcinogenèse, Mutagénèse, Altération de la fertilité
Aucune étude à long terme chez l’animal n’a été réalisée pour évaluer le potentiel cancérogène de l’héparine sodique. De plus, aucune étude de reproduction chez l’animal n’a été réalisée concernant la mutagenèse ou l’altération de la fertilité.
Grossesse
Effets tératogènes
Grossesse Catégorie C
Aucune étude de reproduction chez l’animal n’a été menée avec l’héparine sodique. On ne sait pas non plus si l’héparine sodique peut causer des dommages fœtaux lorsqu’elle est administrée à une femme enceinte ou si elle peut affecter la capacité de reproduction. L’héparine sodique ne doit être administrée à une femme enceinte que si cela est clairement nécessaire.
Effets non tératogènes
L’héparine ne franchit pas la barrière placentaire.
Mères allaitantes
L’héparine n’est pas excrétée dans le lait maternel.
Utilisation pédiatrique
L’innocuité et l’efficacité chez les patients pédiatriques n’ont pas été établies (voir MISES en GARDE, Utilisation chez les nouveau-nés et les nourrissons).
Utilisation gériatrique
Une incidence plus élevée de saignements a été rapportée chez les patients de plus de 60 ans, en particulier chez les femmes (voir PHARMACOLOGIE CLINIQUE et PRÉCAUTIONS, Généralités).
Effets indésirables
Hémorragie
L’hémorragie est la principale complication pouvant résulter de l’utilisation d’héparine (voirappareils, Hémorragie). Un temps de coagulation trop prolongé ou des saignements mineurs pendant le traitement peuvent généralement être contrôlés en retirant le médicament (voir SURDOSAGE).
Thrombocytopénie, Thrombocytopénie induite par l’héparine (HIT) et Thrombocytopénie et Thrombose induites par l’héparine (HITT) et Apparition retardée de HIT et HITT
Voirles avertissements.
Irritation locale
Une irritation locale et un érythème ont été rapportés lors de l’utilisation de la solution Héparine Lock Flush.
Hypersensibilité
Des réactions d’hypersensibilité généralisées ont été rapportées, avec des frissons, de la fièvre et de l’urticaire comme manifestations les plus habituelles, et de l’asthme, de la rhinite, des larmoiements, des maux de tête, des nausées et des vomissements, et des réactions anaphylactoïdes, y compris un choc, survenant plus rarement. Des démangeaisons et des brûlures, en particulier du côté plantaire des pieds, peuvent survenir.
Une thrombocytopénie a été rapportée chez des patients recevant de l’héparine avec une incidence pouvant atteindre 30 %. Bien que souvent bénigne et sans signification clinique évidente, une telle thrombocytopénie peut s’accompagner de complications thromboemboliques graves telles qu’une nécrose cutanée, une gangrène des extrémités pouvant entraîner une amputation, un infarctus du myocarde, une embolie pulmonaire, un accident vasculaire cérébral et éventuellement la mort. (Voir MISES EN GARDE et PRÉCAUTIONS.)
Certains épisodes de membres douloureux, ischémiques et cyanosés ont été attribués par le passé à des réactions vasospastiques allergiques. Reste à déterminer si celles-ci sont en fait identiques aux complications associées à la thrombocytopénie.
Surdosage
Symptômes
Le saignement est le principal signe de surdosage à l’héparine. Les saignements de nez, le sang dans l’urine ou les selles goudronneuses peuvent être notés comme le premier signe de saignement. Des ecchymoses faciles ou des formations pétéchiales peuvent précéder un saignement franc.
Traitement – Neutralisation de l’effet de l’héparine
Lorsque les circonstances cliniques (saignement) nécessitent une inversion de l’héparinisation, le sulfate de protamine (solution à 1%) par perfusion lente neutralisera l’héparine sodique. Pas plus de 50 mg ne doivent être administrés, très lentement, par période de 10 minutes. Chaque mg de sulfate de protamine neutralise environ 100 unités d’héparine USP. La quantité de protamine nécessaire diminue avec le temps à mesure que l’héparine est métabolisée. Bien que le métabolisme de l’héparine soit complexe, il peut être supposé, aux fins du choix d’une dose de protamine, avoir une demi-vie d’environ 1/2 heure après l’injection intraveineuse.
L’administration de sulfate de protamine peut provoquer des réactions hypotensives et anaphylactoïdes sévères. Étant donné que des réactions fatales ressemblant souvent à une anaphylaxie ont été rapportées, le médicament ne doit être administré que lorsque les techniques de réanimation et le traitement du choc anaphylactoïde sont facilement disponibles.
Pour plus d’informations, consultez l’étiquetage des produits USP pour injection de sulfate de protamine.
Dosage et administration de Hep-Lock
Les médicaments parentéraux doivent être inspectés visuellement pour détecter la présence de particules et la décoloration avant l’administration, lorsque la solution et le contenant le permettent. Une légère décoloration n’altère pas la puissance.
Une solution de rinçage à l’héparine sans conservateur à la concentration de 100 unités/mL n’est pas recommandée chez les nouveau-nés et les nourrissons (voir MISES en GARDE, Utilisation chez les nouveau-nés et les nourrissons).
Maintien de la Perméabilité des Dispositifs Intraveineux
Pour éviter la formation de caillots dans un ensemble de verrous d’héparine ou un cathéter veineux central après son insertion correcte, une Solution de rinçage de Verrous d’héparine, l’USP est injectée via le moyeu d’injection en quantité suffisante pour remplir l’ensemble du dispositif. Cette solution doit être remplacée chaque fois que l’appareil est utilisé. Aspirer avant d’administrer une solution via l’appareil afin de confirmer la perméabilité et l’emplacement de l’aiguille ou de la pointe du cathéter. Si le médicament à administrer est incompatible avec l’héparine, l’ensemble du dispositif doit être rincé avec une solution saline normale avant et après l’administration du médicament; après le deuxième rinçage salin, la solution de rinçage à l’héparine, l’USP peut être réintroduite dans le dispositif. Les instructions du fabricant de l’appareil doivent être consultées pour les détails concernant son utilisation. Habituellement, cette solution diluée d’héparine maintiendra l’anticoagulation dans l’appareil jusqu’à 4 heures.
REMARQUE: Étant donné que des injections répétées de petites doses d’héparine peuvent modifier les tests de temps de thromboplastine partielle activée (TPA), une valeur de base pour le TPA doit être obtenue avant l’insertion d’un dispositif intraveineux.
Prélèvement d’Échantillons de sang
Solution de rinçage à l’héparine sans conservateur, USP peut également être utilisée après chaque prélèvement de sang pour des tests de laboratoire. Lorsque l’héparine interfère avec les résultats des analyses de sang ou les modifie, la solution d’héparine doit être éliminée de l’appareil en l’aspirant et en la jetant avant de prélever l’échantillon de sang.
Comment est fourni Hep-Lock
Hep-Lock U/P (Solution de rinçage à l’héparine sans conservateur, USP)
10 unités USP/ mL
Flacons DOSETTES de 1 mL conditionnés en 25s (NDC 0641-0272-25)
100 unités USP/ mL
Flacons DOSETTES de 1 mL conditionnés en 25s (NDC 0641-0273-25)
Stockage
Conserver à 20-25 °C (68-77 °F).
- Tahata T, Shigehito M, Kusuhara K, Ueda Y, et al. Début retardé de la thrombocytopénie induite par l’héparine – Un rapport de cas – J Jpn Assn Torca Surg. 1992; 40 (3): 110-111.
- Warkentin T, Kelton J. Thrombocytopénie et thrombose induites par l’héparine à Début retardé. Annales de médecine interne. 2001;135:502-506.
- Rice L, Attisha W, Drexler A, Francis J. Thrombocytopénie induite par l’héparine à début retardé. Annales de médecine interne, 2002; 136: 210-215.
- Dieck J., C. Rizo-Patron, et al. (1990). « Une Nouvelle Alternative de Manifestation et de Traitement pour la Thrombose induite par l’héparine.” Poitrine.1990;98:1524-26.
- Smythe M, Stephens J, Mattson. Thrombocytopénie induite Par L’héparine À Début Retardé. Annales de Médecine d’Urgence, 2005;45(4):417-419.
- Divgi A. (Réimpression), Thumma S., Hari P., Friedman K., Thrombocytopénie Induite Par l’Héparine à Début Retardé (HIT) Se Présentant Après Une Exposition Non Documentée au Médicament comme Une Embolie Pulmonaire Post-Angiographie. Sang. 2003; 102(11): 127b.
Le logo ESI, Hep-Lock et Dosette sont des marques déposées de Baxter International, Inc., ou ses filiales.
Fabriqué par
Baxter Healthcare Corporation
Deerfield, IL 60015 États-Unis
Pour Demande de produit 1 800 MÉDICAMENT ANA (1-800-262-3784)
MLT-00090/6.0
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Baxter Healthcare Corporation
Medical Disclaimer